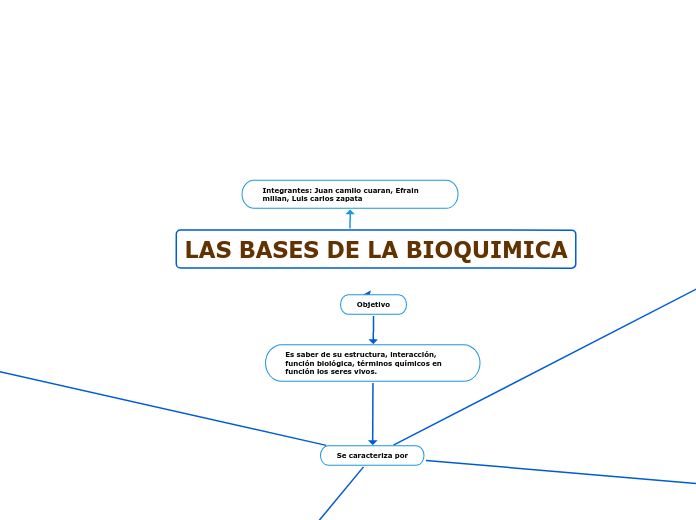
Integrantes: Juan camilo cuaran, Efrain millan, Luis carlos zapata
LAS BASES DE LA BIOQUIMICA
Objetivo
Es saber de su estructura, interacción, función biológica, términos químicos en función los seres vivos.
Se caracteriza por
CONTEXTO CELULAR
Los niveles de organización molecular de las células permite decir que
Tercer nivel: celular o los orgánulos celulares
Segundo nivel: lo formaran las estructuras o complejos grupos moleculares del tercer nivel, sobre todo mediante interacciones débiles
Primer nivel: monomeros
LAS REACCIONES QUIMICAS EN LA CELULA
Se divide en
3-Reactividad de las moléculas biológicas
También un grupo funcional que tiene un átomo electronegativo que puede generar un dipolo portando un centro nucleófilo y un electrófilo que proporciona diferentes reacciones químicas
Como
Reacción de deshidratación
Reacciones de condensación
La presencia de grupos funcionales en las biomoléculas proporcionan sitios reactivos, donde dichas moléculas van a unirse a otras o reaccionar y transformarse
Los sitios reactivos pueden ser
Electrófilos (atracción por electrones)
Nucleófilos (atracción por el núcleo)
2-Ácidos y alcalosis
Cuando se traducen los ajustes entre la producción y eliminación de ácidos o bases en el organismo.
Su producción es la siguiente
Alcalosis
Se produce cuando hay exceso de base en los liquidos.
Tipos
Respiratorio
Metabólico
Acidosis
Se produce acidosis cuando hay demasiado acido liquido en el cuerpo se clasifica por metabólica y respiratoria
ácido volátiles
ácido fijos
1-Equilibrio de una reacción química
Una reacción química, donde interactúan para formar productos, la mayoría de las reacciones químicas no finalizan cuando se ha convertido en producto en lugar de ello el producto formado reacciona a un nuevo reactivo
Entendemos que
La velocidad de reacción va hacia adelante es decir, formación de producto y la reacción marcha atrás es formación reactiva esto hace que se igualen y la reacción alcanza el equilibrio
EL AGUA COMO PRINCIPAL DISOLVENTE BILOGICO
se dividen en
4-La soluciones tampón regulan el PH de la célula
Se define como
Sistemas acuosos que amortiguan los cambios del PH cuando se añade acido o base
Se constituyen por
Un acido débil y base conjugada
Tener en cuenta que
Cuando el valor del PH de la solución es igual al PK del sistema, entonces las concentraciones de las especies que definen el sistema serán iguales
El principal sanguíneo es
Es el sistema de tampón bicarbonato, compuesto por el acido débil carbónico y la base conjugada bicarbonato
3-El Ph
La concentración de iones hidronio o de protones que presente en una solución ácida, alcalina o básica
Tener en cuenta
Para no usar números pequeños se hizo una escala algorítmica denominada escala del PH que comprende el valor de 0 a 14
2-Químicos de los ácidos y las bases
El comportamiento de la ionización del agua y es importante para entender el concepto de acido y base
Se define una sustancia de un ácido que puede ceder un protón y aceptar una base de un protón a reaccionar con un acido
Cabe destacar
En las moléculas biológicas en un grupo pequeño funcional donde se comportan como ácidos o bases y hay que tener en cuenta su comportamiento en el medio fisiológico ya que implica en los seres vivos
1-La molécula de agua es un dipolo
¿Qué es?
El agua es el liquido fundamental para la mayor parte de las reacciones químicas de la célula y es el principal disolvente biológico
La molecula de agua que se comporta como un dipolo y esta conformado por el atomo de O, con carga parcial negativa y los dos atomos de H, con carga parcial positiva
Esto se debe
A la diferente electro negatividad
Por lo cual
La interacciones debiles de la molecula de agua que estan a su alrededor realizan puentes de hidrogeno
Esto hace
Que el enlace débil que es de vital importancia para la formación y ruptura de los enlaces pero principalmente para disolver moléculas biológicas
Por ende
La formación y ruptura de puentes de hidrogeno con las moléculas de agua es a la temperatura fisiológica y no es constante que la molécula de agua se disocia en dos especies iónicas
Iones hidroxilo
Iones hidronio
Fundamentos químicos
10-Interacción hidrofóbicas
Las fuerzas hidrofóbicas que no presentan naturaleza electroestática se da entre moléculas y grupos funcionales no polares ya que la fuerza de las moléculas apolares tienden a expulsar el agua por su repulsión
La interacciones hidrofóbicas en la naturaleza apolar son fundamentales en la biología ya que muchos componentes se mantienen unidos y formando varias estructuras para alejar el agua y hacer barreras hidrofóbicas
9-Fuerzas de Vander Waals
Interacciones débiles que temporalmente mantienen unidas a átomos o moléculas no polares
Se entiende
Que son dipolos temporales de interacciones de tipo carga-carga
Pero depende
De una distancia entre átomos que solo en el momento cuando el electrón de un átomo se acerca o se aleja con el que esta enlazado y no es necesario que las moléculas sean polares
8-Interacción débil
Entendemos
Todo proceso biológico se produce a las interacciones débiles entre moléculas
Por lo tanto
Estas interacciones débiles hacen que la unión y reconocimiento entre una enzima y un sustrato o de receptor y su ligando o como proceso de replicación y transcripción de DNA hacen que la suma de muchas de ellas en la posición correcta sea altamente especifica y fuerte para la vida vital de la célula
Se comprende por
La interacción de tipo electroestático entre cargas opuestas en los iones, donde se denomina puente salino
Se define
Los iones como grupo funcionales ya que son ácidos o bases
Capacidad de ceder un protón al medio o captarlo ya que presenta una carga real, esto lo convierte en ion
Ya que
Los puentes salinos no son dependientes de la distancia orientada entre átomos como los puentes de hidrogeno
Puente de hidrogeno
De naturaleza relativamente fuerte donde es común entre moléculas polares en un medio acuoso y hace múltiples uniones débiles entre las moléculas de agua
Se forman por
La presencia de un átomo de hidrogeno unido covalentemente a un átomo electronegativo
7-Grupos funcionales en biomoléculas
Sabemos que el H solo necesita compartir un electrón el O dos electrones, el N tres electrones y el C 4 electrones para completar su ultima capa
Hay compuestos con
Nitrógeno, Fosforo, azufre, hidrogeno y oxigeno
6-Grupos fundamentales entre biomoléculas
Tienen
Unas molécula viva que debe estar en constante cambios forman asociaciones entre ellas o en el agua
Se comprenden en
Elementos químicos fundamentales en la reactividad de las biomoléculas como el O y el N, estos átomos harán reaccionar a las moléculas que lo porten
Diferentes biomoléculas de los seres vivos que son recurrentes de seres de grupos funcionales
Determina
La naturaleza del funcionamiento de la molécula biológica
5-Polaridad
Dos elementos de electronegatividades diferentes donde forman un enlace covalente
Donde
Un enlace covalente polar se forma por el átomo mas electronegativo donde hay mayor densidad de carga negativa, mientras que otro adquiere carga positiva provocada por la ausencia del electrón que neutraliza la carga positiva
Se forma
Un dipolo donde dos cargas de signos opuestos separados por una distancia determinada
4-Los elementos se combinan y forman moléculas
Se relaciona con
Enlace covalente
Los estudiados hasta el momento comparten un par de electrones y los aportan a los átomos que participan en el enlace en donde el par de electrones compartidos procede exclusivamente de uno de los átomos
Enlace iónico
Es
El resultado de la presencia de atracción electroestática entre los iones de distintos signos respecto a las Valencias de los elementos y el numero de electrones que deben completar las capas
La regla del octeto
Los elementos son mas estables cuando consiguen 8 electrones así sean pares solitarios o compartidos
Sin embargo
El hidrogeno tiene excepción ya que solo tiene un electrón en su capa de Valencia
3-Formación de moléculas
Se forman
De la unión entre átomos donde se establece los enlaces químicos
Se componen
Por las moléculas donde se forman los átomos de diferentes elementos donde se denomina compuesto
También
Los electrones de las ultimas capas que ocupan mayor energía se le conoce como electrón de Valencia
2-Tabla periódica
Señala
Elementos químicos presentes en los seres vivos
Se dividen en
Símbolos, números masico y numero atómico
Se ordena
De izquierda a derecha según si aumenta el numero de protones o de electrones si el átomo es neutro
1-ATOMO
Partícula de tamaño reducido y se constituye por subpartículas
Son
Protón, neutrón y electrón
Hay átomos cargados denominados iones
Que son
Aniones con mayor carga de electrones negativa
Cationes con mayor numero de protones con carga positiva