af Mario Izaguirre 3 år siden
253
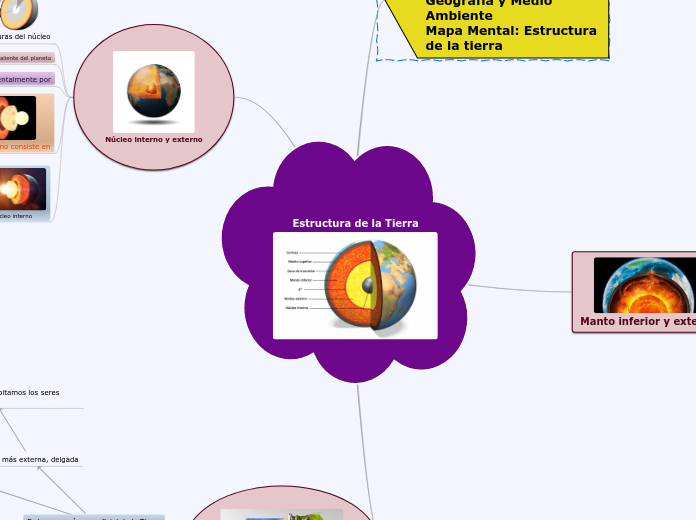
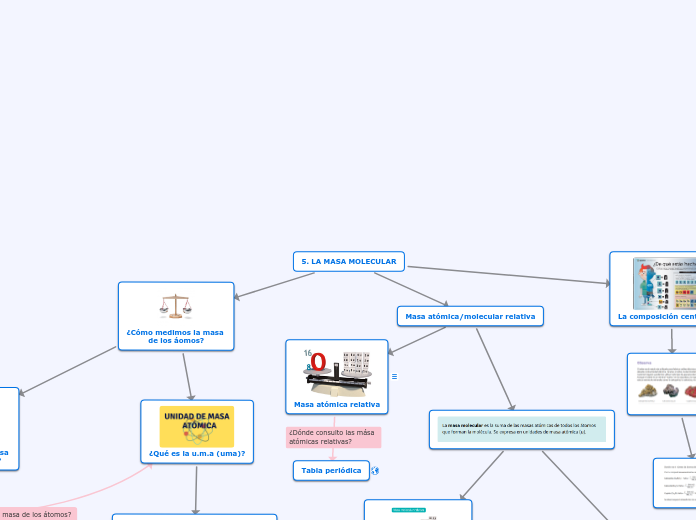
Materia, Estructura y Periodicidad
La masa se refiere a la cantidad de materia en un objeto y es fundamental para entender fenómenos como la gravedad. Las sustancias puras se dividen en elementos y compuestos, y su estudio ha sido clave en el desarrollo de la química.