Enlace Químico y Nomenclatura Inorgánica
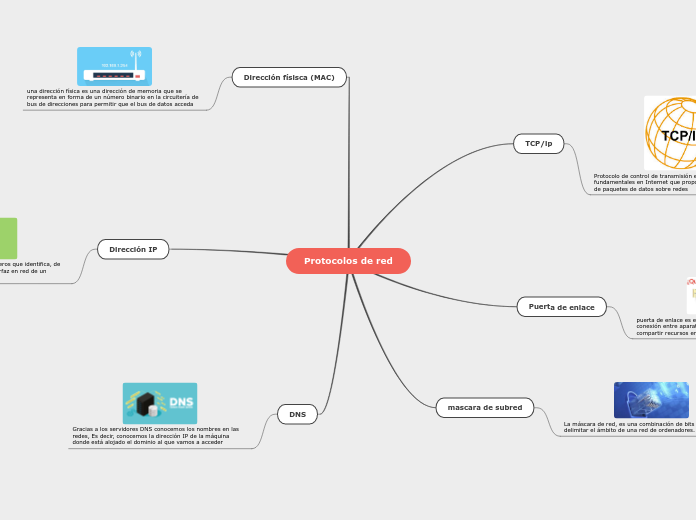
Enlace Químico
Es la fuerza existente entre los átomos una vez que se ha formado un sistema establece
El enlace covalente
En este enlace no se transfieren ni se reciben electrones, la fuerza de atracción surge al ser compartidos
Enlaces covalentes según el número de electrones que aporta cada átomo al enlace
Este tipo de enlaces se conoce con el nombre de covalente coordinado o dativo. El átomo que aporta la pareja de electrones se llama dador o donador y el que los acepta o recibe, receptor o aceptor
covalente coordinado o dativo.
este tipo de enlace se representa mediante una flecha que va del átomo que aporta el par de electrones al átomo que los recibe.
El enlace metálico
Este es un enlace fuerte que se forma entre elementos metálicos
Los enlaces de los metales no son rígidos; cuando un metal de golpes, los átomos se deslizan o se resbalan unos con respecto a otros dentro del mar de lectrones y se reorganizan hasta ocupar un nuevo sitio, manteniendo la unión con los otros átomos
Características de los compuestos covalentes
los compuestos covalentes presentan las siguientes características
Se pueden encontrar en los tres estados; sólido, líquido y gaseoso.
La mayoría son compuestos orgánicos
Sus reacciones son lentas; generalmente, necesitan de catalizadores
Poseen puntos de fusión y ebullición relativamente bajos.
Enlaces covalentes según la diferencia de electronegatividad
Los enlaces covalentes pueden ser apolares o no polares y polares, dependiendo de la diferencia de electronegatividad entre los átomos que forman el enlace.
Covalente polar
los átomos tienen diferentes electronegatividades (diferencia está entre 0,99 y 1,7), y como resultado, un átomo tiene mayor fuerza de atracción por el par de electrones compartido que el otro átomo
(H-O-H) Electronegatividad (H=2.2)(O=3.44)
la diferencia de elctronegatividades es de 1.24 , se encuentra en el rango entre 0.99 y 1.7, por lo tanto es un enlace polar
Covalente apolar o no polar
Este tipo de enlace se presenta cuando los átomos que comparten electrones tienen igual o muy semejante electronegatividad y la diferencia entre ellas está entre 0 y 0,99.
(H-H)Electronegatividad es de 2.2
la diferencia de elctronegatividades es de 0, se encuentra en el rango entre 0 y 0.99, por lo tanto es un enlace no polar
Enlaces covalentes según el número de electrones compartidos
Enlace covalente doble
Cada átomo aporta dos electrones al enlace, es decir, se comparten dos pares de electrones entre dos átomos
Molécula de oxígeno (O2): O=O.
Enlace covalente triple
Cada átomo aporta tres electrones al enlace, es decir, se comparten tres pares de electrones entre dos átomos
ejemplo
Molécula de nitrógeno (N2): N Ξ N
Enlace covalente sencillo
En este enlace se comparte un par de electrones, donde cada átomo de los que intervienen en el enlace aporta uno
Este tipo de unión se puede realizar entre átomos iguales o entre átomos diferentes
Ejemplo
Molécula de hidrógeno (H2): H-H.
enlace iónico
Es el resultado de la transferencia de uno o más electrones de una tomo a otro; es la pérdida o ganancia donde un átomo gana electrones y otro los acepta.
también se lo conoce como enlace electrovalente y se forma principalmente entre átomos con marcada diferencia de electronegatividades
Los compuestos cuyos elementos están unidos por enlaces iónicos se llaman compuestos iónicos y presentan las siguientes características
No forman moléculas, sino redes cristalinas. Por lo tanto, son sólidos a temperatura ambiente
Son duros y frágiles
En estado sólido no conducen la corriente eléctrica, pero fundidos o disueltos en agua conducen la electricidad, debido a que los iones se separan y pueden moverse en forma independiente
La forma del cristal es forma geométrica (cúbica, rómbica, hexagonal, entre otras).
Nomenclatura Inorgánica
Es un sistema de símbolos y nombres, tanto para los elelmentos químicos como para los compuestos que resultan de las combinaciones químicas.
Resonancia
La suma o mezcla de todas las estructuras de Lewis posibles para la misma. La resonancia se indica mediante una flecha con doble punta.
Estructura de Lewis
es una representación gráfica que muestra los pares de electrones en guiones o puntos de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir.
Carga formal
es una carga parcial de un átomo en una molécula,asignada al asumir que los electrones en un enlace químico se comparten por igual entre losátomos, sin consideraciones de electronegatividad relativa
Ley del octeto
es una regla práctica aproximada que presenta numerosas excepciones, pero que sirve para predecir el comportamiento de muchas sustancias, la regla del octeto establece que sólo mediante la acumulación de ocho electrones en la última órbita