af Alexa Criollo 3 år siden
262
QUÍMICA
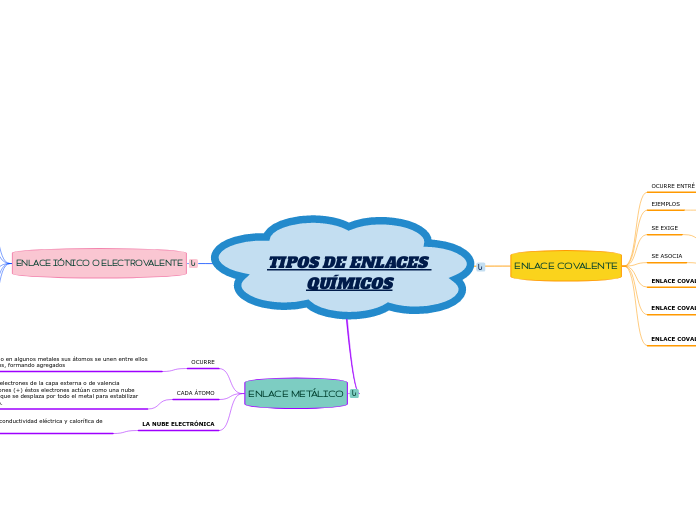
Los enlaces químicos son fundamentales para entender la formación de compuestos y la estabilización de átomos. Existen tres tipos principales de enlaces: iónico, metálico y covalente.
af Alexa Criollo 3 år siden
262

Mere som dette