af Sofía Beltrán 4 år siden
374
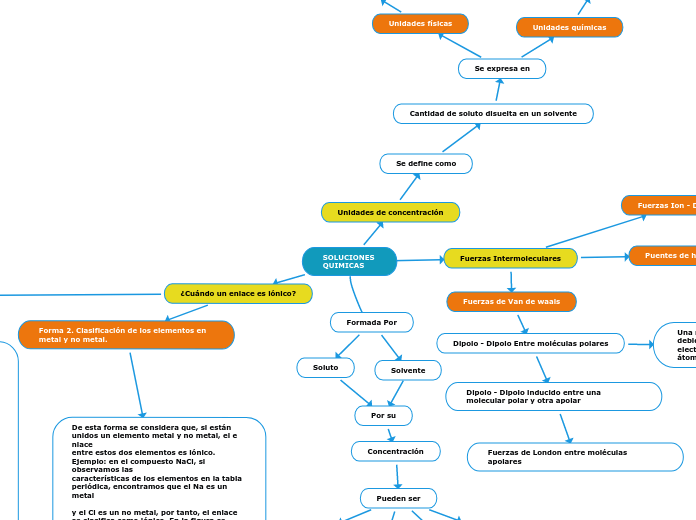
SOLUCIONES QUIMICAS
Las soluciones químicas se componen de solutos disueltos en solventes y su concentración puede expresarse en varias unidades, como molaridad, molalidad y normalidad, o en términos porcentuales.
af Sofía Beltrán 4 år siden
374

Mere som dette
Se expresa en
Unidades químicas
Normalidad
Molalidad
Molaridad
Unidades físicas
Como
% masa/volumen
& volumen/volumen
% masa/masa
Este tipo de interacción es muy fuerte, por ello, la mayoría de sustancias iónicas se disuelven en sustancias polares como el agua.
Una molécula se polariza debido a la diferencia de electronegatividad entre los átomos que la constituyen.
Dipolo - Dipolo inducido entre una molecular polar y otra apolar
Fuerzas de London entre moléculas apolares
Concentración
Pueden ser
Diluida
Saturada
Sobresaturada
Concentrada