von Marializ Bolivar Vor 5 Jahren
1369
LAS SOLUCIONES
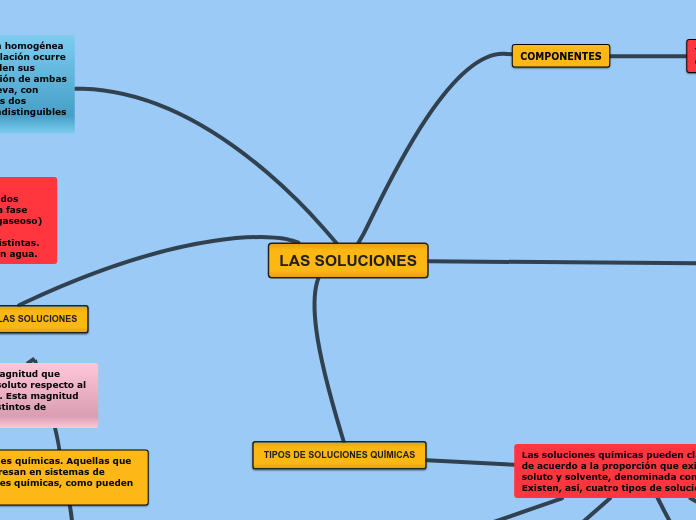
Una solución química es una mezcla homogénea de dos o más sustancias donde las propiedades individuales de los componentes se modifican o pierden debido a la formación de nuevos enlaces químicos.
von Marializ Bolivar Vor 5 Jahren
1369

Mehr dazu