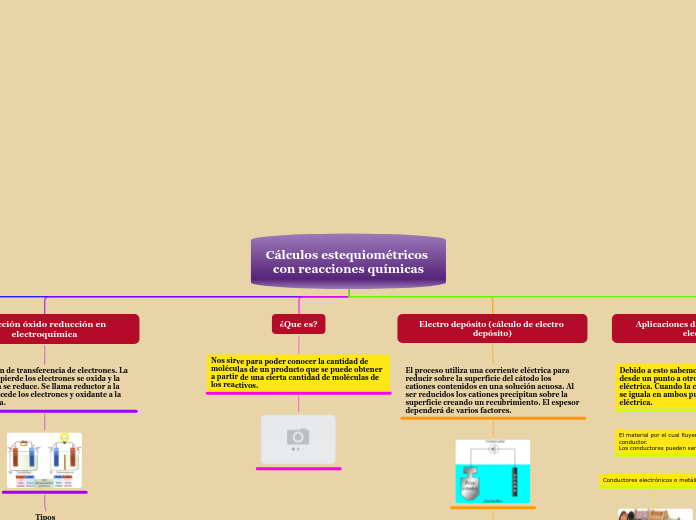
Cálculos estequiométricos con reacciones químicas
Nano química (propiedades fisicoquímicas no convencionales de polímeros Catenanos y Rotaxanos)
Las investigaciones de máquinas moleculares inspirándose en la mecánica biológica, muchos han buscado formar sistemas moleculares en movimiento para generar trabajo que promete tener muchas aplicaciones. De interés especial para estos propósitos son un tipo de moléculas llamadas Catenanos y Rotaxanos.
Rotaxanos
La síntesis de este tipo de estructuras era muy difícil ya que se utilizaban únicamente fuerzas intermoleculares e interacciones ácido-base para dirigir la reacción. En la actualidad ya no existen ese tipo de impedimentos ya que se han diseñado métodos de síntesis que incorporan metales de transición para dirigir la reacción.
Catenanos
Estructuras formadas por la interconexión de dos o más macro-ciclos para formar una cadena, con cada macro ciclos tomando el papel de un eslabón.
Aplicaciones de electroquímica en electrónica.
Debido a esto sabemos que el flujo de electrones desde un punto a otro se llama corriente eléctrica. Cuando la concentración de electrones se iguala en ambos puntos, cesa la corriente eléctrica.
El material por el cual fluyen los electrones se denomina conductor.
Los conductores pueden ser de dos tipos:
Los conductores electrolíticos.
Conductores electrónicos o metálicos.
Electro depósito (cálculo de electro depósito)
El proceso utiliza una corriente eléctrica para reducir sobre la superficie del cátodo los cationes contenidos en una solución acuosa. Al ser reducidos los cationes precipitan sobre la superficie creando un recubrimiento. El espesor dependerá de varios factores.
¿Que es?
Nos sirve para poder conocer la cantidad de moléculas de un producto que se puede obtener a partir de una cierta cantidad de moléculas de los reactivos.
Reacción óxido reducción en electroquímica
Una reacción de transferencia de electrones. La especie que pierde los electrones se oxida y la que los gana se reduce. Se llama reductor a la especie que cede los electrones y oxidante a la que los capta.
Fuerza electromotriz (fem) en una celda electroquímica
Es un dispositivo experimental para producir electricidad mediante una reacción redox espontanea en donde la sustancia oxidante se encuentra separada de la reductora de manera que los electrones deben atravesar un alambre de la sustancia reductora hacia el oxidante.
Calculo de la fem y potenciales de óxido reducción
Se calcula mediante la relación: "fem = Potencial más positivo — Potencial más negativo", sin cambiar nunca los valores reportados en la tabla a menos que las condiciones de concentración, presión o temperatura sean diferentes a las estándar.