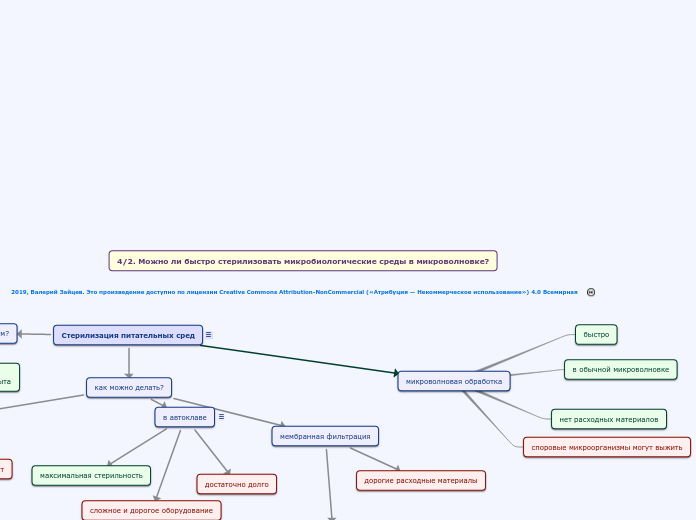
микроволновая обработка
споровые микроорганизмы могут выжить
нет расходных материалов
в обычной микроволновке
быстро
Использованные публикации
Wynn, Dixon, 1988
Wynn B., Dixon A. Microwave sterilization in school microbiology. J. Biol. Educ. 1988; 22(4) 289-294. doi: 10.1080/00219266.1988.9655002
Shareef e.a., 2019
Shareef S.A., Hamasaeed P.A., Ismaeil A.S. Sterilization of Culture Media for Microorganisms Using a Microwave Oven Instead of Autoclave. Rafidain J. Sci. 2019; 28(2): 1-6. doi: 10.33899/rjs.2019.159390
Sanborn e.a., 1982
Sanborn M.R., Wan S.K., Bulard R. Microwave sterilization of plastic tissue culture vessels for reuse. Appl. Environ. Microbiol. 1982; 44(4): 960-964.
Prijana e.a., 2016
Prijana C., Mulyana Y., Hidayat B. Roles of Microwave Oven in Preparing Microbiological Growth Media. Althea Med. J. 2016; 3(1): 1-5. DOI: 10.15850/amj.v3n1.469
Kothari e.a., 2011
Kothari V., Patadia M., Trivedi N. Microwave sterilized media supports better microbial growth than autoclaved media. Res. Biotechnol. 2011; 2(5): 63-72.
Bhattacharjee, Delsol, 2014
Bhattacharjee M.K., Delsol J.K. Does microwave sterilization of growth media involve any non-thermal effect? J. Microbiol. Methods. 2014; 96: 70-72. doi: 10.1016/j.mimet.2013.11.002
Baqai, Hafiz, 1992
Baqai R., Hafiz S. Microwave oven in microbiology laboratory. J. Pak. Med. Assoc. 1992; 42(1): 2-3.
Лабораторная работа 4/2
оформление результатов
Выполняется внеаудиторно. Загружается дистанционно для оценки преподавателем с использованием выбранного формата интерактивного общения (LMS, облачное файлохранилище, социальные сети, онлайн-сервисы организации совместной работы и т.д.).
все протоколы - описательное
В свободной форме, содержащей:
- рабочие протоколы выполнения работы,
- фотографии поэтапного выполнения протоколов.
лабораторные протоколы
Протоколы
Важно! В лабораторной работе 4/2 НЕ производится инокуляции питательных сред микроорганизмами.
4/2 е. Приготовление агара на основе селитряного удобрения
Протокол выполнения опыта
Приготовление среды
- для приготовления 100 мл среды возьмите половину чайной ложки сахара и растворите его в 80 мл теплой воды;
- отмерьте 1 чайную ложку жидкого комплексного удобрения «Калийная селитра» с микро- и макрооэлементами с содержанием азота 6-8% и добавьте к смеси, хорошо перемешайте;
- добавьте 1,2 г агар-агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агар-агара;
- закройте колбу плотно ватно-марлевой пробкой.
Стерилизация среды
- полученную среду без комочков перелить в стеклянную бутыль со слегка недокрученной автоклавируемой резьбовой крышкой типа GL45 и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт.
Заливка чашек Петри автоклавированной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
4/2 д. Приготовление агара Чапека
Протокол выполнения опыта
Приготовление среды
- для приготовления 100 мл среды взвесьте 3 г сахарозы, 0,2 г натрия нитрата, 0,1 г калия гидрофосфата, 0,05 г магния сульфата, 0,05 г калия хлорида и 10 мг железа(II) сульфата;
- растворите все в 80 мл теплой воды;
- добавьте 1,5 г агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агара;
- закройте колбу плотно ватно-марлевой пробкой.
Стерилизация среды
- полученную среду без комочков перелить в стеклянную бутыль со слегка недокрученной автоклавируемой резьбовой крышкой типа GL45 и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт.
Заливка чашек Петри стерилизованной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
4/2 г. Приготовление картофельно-глюкозного бульона
Протокол выполнения опыта
Приготовление среды
- для приготовления 100 мл среды нарежьте 20 г неочищенного картофеля тонкими ломтиками;
- прокипятите 30 мин в 100 мл воды;
- профильтруйте отвар (ломтики картофеля отбросьте);
- отвар охладите, добавьте 2 г глюкозы;
- доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу, закройте её плотно ватно-марлевой пробкой.
Стерилизация среды
- полученную среду без комочков перелить в стеклянную бутыль со слегка недокрученной автоклавируемой резьбовой крышкой типа GL45 и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт.
Заливка стерилизованной среды в пробирки
- стерилизованную среду охладить до температуры примерно 30°С и добавить в неё по 1 мл стерильных растворов хлортетрациклина или тетрациклина (4 мг/мл) и хлорамфеникола (левомицетина) (2,5 мг/мл);
- разлить в большие культуральные пробирки по 15-20 мл (в зависимости от размера пробирки) в стерильных условиях (например, в ламинарном шкафу);
- поставьте необходимые пометки на пробирках и закройте их;
- передайте пробирки лаборанту для инкубации до занятия 5.
4/2 в. Приготовление жидкой среды YPD
Протокол выполнения опыта
Приготовление среды
- для приготовления 100 мл среды взвесьте 0,3 г дрожжевого экстракта, 1 г пептона и 1 г глюкозы;
- растворите всё в 80 мл теплой воды;
- доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу, закройте её плотно ватно-марлевой пробкой.
Стерилизация среды
- полученную среду без комочков перелить в стеклянную бутыль со слегка недокрученной автоклавируемой резьбовой крышкой типа GL45 и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт.
Заливка стерилизованной среды в пробирки
- стерилизованную среду охладить до температуры примерно 30°С и добавить в неё по 1 мл стерильных растворов хлортетрациклина или тетрациклина (4 мг/мл) и хлорамфеникола (левомицетина) (2,5 мг/мл);
- разлить в большие культуральные пробирке по 15-20 мл (в зависимости от размера пробирки) в стерильных условиях (например, в ламинарном шкафу);
- поставьте необходимые пометки на пробирках и закройте их;
- передайте пробирки лаборанту для инкубации до занятия 5.
4/2 б. Приготовление твердой среды из сухого пищевого бульона
Протокол выполнения опыта
Приготовление среды
- для приготовления 100 мл среды возьмите 2 чайных ложки сахара и 1 чайную ложку куриного или говяжего сухого бульона;
- хорошо размешайте всё в 80 мл теплой воды;
- добавьте 1,2 г агар-агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агар-агара;
- закройте колбу плотно ватно-марлевой пробкой;
- передайте колбу лаборанту для стерилизации в автоклаве.
Стерилизация среды
- полученную среду без комочков перелить в стеклянную бутыль со слегка недокрученной автоклавируемой резьбовой крышкой типа GL45 и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт.
Заливка чашек Петри стерилизованной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
4/2 а. Приготовление LB-агара
Протокол выполнения опыта
Приготовление среды
- для приготовления 100 мл среды взвесьте 1 г ферментативного гидролизата казеина (или триптона, или пептона), 0,5 г дрожжевого экстракта и 1 г NaCl;
- растворите NaCl в 80 мл теплой воды;
- в полученном солевом растворе растворите остальные компоненты среды;
- добавьте 1,5 г агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агара;
- закройте колбу плотно ватно-марлевой пробкой.
Стерилизация среды
- полученную среду без комочков перелить в стеклянную бутыль со слегка недокрученной автоклавируемой резьбовой крышкой типа GL45 и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт.
Заливка чашек Петри стерилизованной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
организация работы
Данная лабораторная работа использует те же протоколы, что и лабораторная работа 4/1, за исключением способа стерилизации и инокуляцией микроорганизмами. Поэтому - по усмотрению преподавателя - все среды из работы 4/1 могут быть приготовлены сразу в удвоенном объеме, а затем они делятся на две равных порции (для стерилизации автоклавированием и микроволновой обработкой), либо среды готовятся по отдельности в рамках каждой лабораторной работы.
В работе используются три контрольных среды (обычно используемые в лабораториях) и три опытных среды (из легко доступных компонентов).
Подготовительная часть (преподаватель + лаборант): подготовка необходимых материалов и оборудования.
Основная часть 1 (студенты в начале занятия): студенты делятся на подгруппы по числу приготавливаемых питательных сред (контрольных и опытных). Студенты стерилизуют свои среды сами в микроволновой печи, а затем разливают свои твердые среды после стерилизации по стерильным чашкам Петри (2 чашки с каждой средой), а жидкие - по стерильным пробиркам (2 с каждой средой); после остывания сред - засевают чашки и пробирки микроорганизмами.
Последующая часть (лаборант): инкубация чашек Петри и пробирок с питательными средами, инокулированных образцами, в термостате (25°С для грибов и 37°С для дрожжей и бактерий) в течение недели до дня занятия 5.
результаты обучения
вопросы для обсуждения
- В чем принципиальные отличия стерилизации культуральных сред микроволновой обработкой от других способов стерилизации?
- Как условия обработки в микроволновой печи могут повлиять на эффективность стерилизации питательных микробиологических сред?
- Могут ли быть ситуации, в которых микроволновая стерилизация в микробиологической лаборатории будет полностью неэффективна или неприменима?
развиваемые навыки
- готовить питательные среды по известным прописям
- стерилизовать питательные среды
- работать в асептических условиях
Стерилизация питательных сред
Одна из наиболее широко применяемых в отечественных исследованиях сред для выращивания инфузорий рода Paramecium - среда Лозино-Лозинского.
Обычно она готовится в виде концентрата 10-кратной концентрации (10x). Концентрат среды Лозина-Лозинского готовится следующим образом: в 1 литре дистиллированной воды растворяют 0,1 г NaCl, 0,01 г KCl, 0,2 г NaHCO3, 0,01 г MgSO4 х 7 H2O, 0,01 г CaCl2. Для приготовления рабочего раствора (инкубационной смеси) смешивают 1 объем концентрата с 9 объемами воды (например, 100 мл концентрата + 900 мл воды).
Культура парамеций лучше всего выращивать при температуре 20-25˚C с естественной рассеянной освещенностью в течении дня или с искусственным чередованием света и темноты («день-ночь») 12 + 12 часов в течение суток.
В качестве корма можно использовать множество веществ и продуктов, но одним из самых простых, доступных и легко стандартизируемых вариантов являются обычные сухие пекарские дрожжи. Активные (быстрорастворимые) дрожжи лучше, чем те, которые требуют предварительной инкубации в жидкости. Рекомендуемый режим кормления 0,07 г сухих дрожжей на культуру объемом 400-600 мл 2 раза в неделю. Перед добавлением в культуру дрожжи суспендируются в 10 мл воды для более равномерного распределения в культуре.
Через каждые 1-2 недели культуру инфузорий требуется отмывать от остатков корма и продуктов метаболизма. Для этого культуру инфузорий переливают в узкогорлую колбу, которую накрывают темной тканью, оставляя открытым горлышко. Средой Лозино-Лозинского доводят до верха. Через некоторое время инфузории выплывают в верхнюю часть колбы, после чего их отбирают дозатором на 10 мл и переносят в чистый стакан, а затем снова доливают средой Лозино-Лозинского. Процедура повторяется до тех пор, пока культура не станет прозрачной. После отмывки инфузории необходимо покормить, а на сосуд с ними поставить дату последней отмывки.
как можно делать?
мембранная фильтрация
дорогие расходные материалы
хорошая стерильность
в автоклаве
Основной лабораторный метод стерилизации
достаточно долго
сложное и дорогое оборудование
максимальная стерильность
кипячением
достаточно колбы и нагрева
легко и просто
не все микробы погибнут
зачем?
чтобы в среду не попали микроорганизмы из окружающей среды и не исказили результаты опыта
2019, Валерий Зайцев. Это произведение доступно по лицензии Creative Commons Attribution-NonCommercial («Атрибуция — Некоммерческое использование») 4.0 Всемирная
4/2. Можно ли быстро стерилизовать микробиологические среды в микроволновке?