por Sebiane Bilal hace 5 años
571
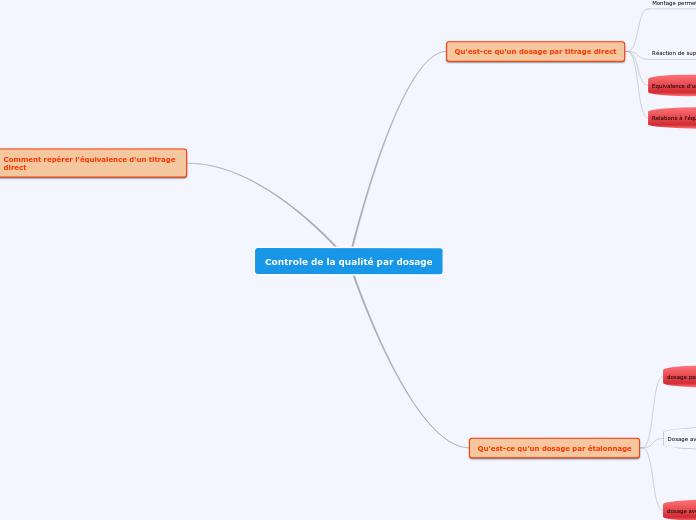
Controle de la qualité par dosage
Le titrage direct est une méthode couramment utilisée en chimie analytique pour déterminer la concentration d'une solution. Cette technique repose sur une réaction chimique quantitative, rapide et unique.