por Domenica Molina hace 3 años
199
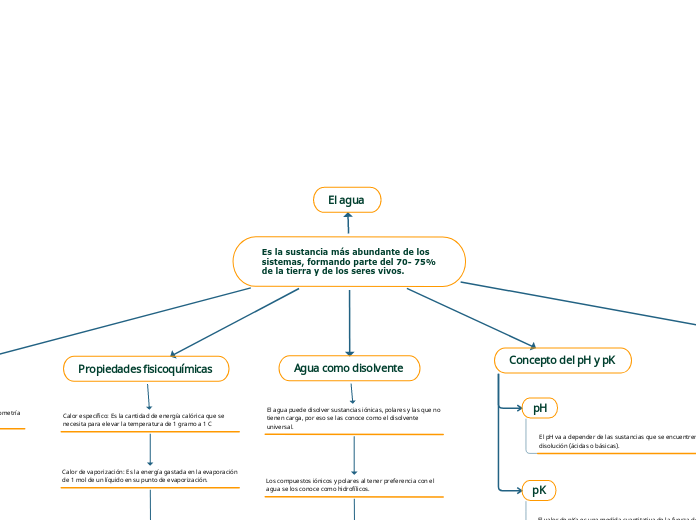
Es la sustancia más abundante de los sistemas, formando parte del 70- 75% de la tierra y de los seres vivos.
El agua es una sustancia esencial en la naturaleza, cubriendo del 70 al 75% de la superficie terrestre y siendo fundamental para los seres vivos. Actúa como un disolvente universal al poder disolver sustancias iónicas y polares, conocidas como hidrofílicas, mientras que los compuestos no polares, denominados hidrófobos, son insolubles en ella.