La interacción entre elementos y moléculas conforman toda la materia y sus propiedades
El átomo es una partícula indivisible
PARTICULAS SUBATÓMICAS
Protones
Ernest Rutherford
MODELO ATÓMICO DE BOHR
Los electrones siguen girando al rededor del núcleo, pero en niveles específicos, los cuales están cuantizados y permiten al electrón girar si perder o ganar energía.Si se le entrega energía al electrón, este puede saltar a un nivel superior
El modelo fisco–matemático sólo era capaz de hacer predicciones para el átomo de hidrogeno
MODELO ATÓMICO MECANOCUÁNTICO
Se basa en probabilidades de dónde se puede encontrar el electrón, en vez de este. Considera los ”cuantos” de Plank.
Tiene que haber un núcleo en el átomo en el cual se contiene la mayoría de la masa
Las partículas alfa se desviaban al pasar por la lamina de oro incluso hasta se devolvían
MODELO ATÓMICO DE RUTHERFORD
Electrones, con una pequeña masa y carga negativa el átomo debe ser neutro.El núcleo de átomo corresponde a protones con gran masa y carga positiva
Si el átomo gira libremente alrededor del núcleo, entonces por un tema de masa y cargas, el electrón debe ser atraído por el núcleo hasta que estos choquen y colapsen
Electrones
JJ Thomson
Como las cargas opuestas se atraen, entonces los rayos catódicos son negativos y que tal vez el rayo catódico es una partícula subatómica
MODELO ATÓMICO THOMSON
Consiste en una partícula positiva, la cual usa todo el volumen del átomo
La distribución de la de la carga positiva en el interior de los átomos era errónea
Que el rayo catódico se acerca a los campos cargados positivamente y que el cambiar el material del cátodo no afectó al experimento
Demócrito
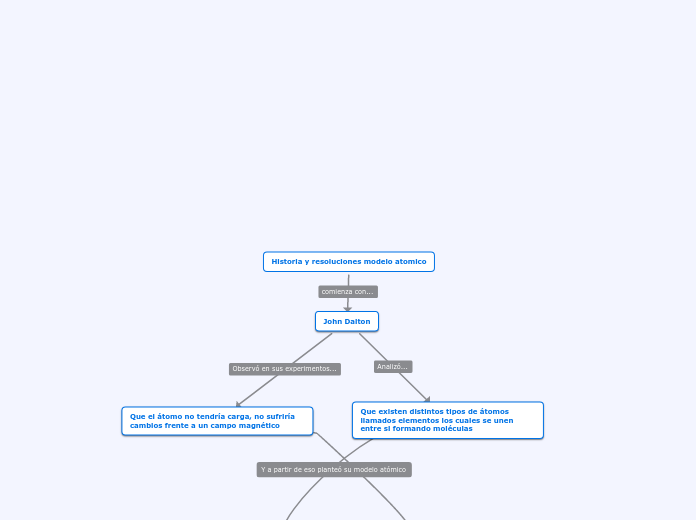
Historia y resoluciones modelo atomico
John Dalton
Que existen distintos tipos de átomos llamados elementos los cuales se unen entre si formando moléculas
Que el átomo no tendría carga, no sufriría cambios frente a un campo magnético
MODELO ATÓMICO DE DALTON