Es una clasificación arbitraria y hay varios elementos que que no se adaptan bien.
Como se comporta el elemento cuando ya está unido
menor posibilidad de ceder un electrón
Radio Ionico
Lo que nos interesa del radio iónico
"La primera energía de ionización"
Que consta de la energía necesaria para extraer un electrón del orbital ocupado por un átomo libre
El radio iónico puede afectar tanto las propiedades físicas, como las químicas de un compuesto iónico.
El radio de un Catión o anión, y está estrechamente relacionado con la configuración electrónica.
se mide a travez
de la difracción rayos X
Leyes Periodicas
División de elementos
Metaloides
Propiedades características tanto de los metales como de los no metales.
Ejemplo es el aluminio, es el mas metálico de los metaloides, pero su conductividad aumente al elevar la temperatura, al contrario de los metales que disminuye.
Metales
Estado solido se caracteriza por el enlace metálico
Forman óxidos iónicos y básicos, Forman cationes en agua
Buenos conductores del calor y electricidad (disminuye al aumentar la temperatura), Aspecto brillante, Maleables y dúctiles.
No Metales
Forman óxidos covalentes y ácidos Forman oxoaniones en agua
Sin brillo, Duros y quebradizos, Malos conductores del calor(excepto el carbono en forma de diamante) y la electricidad (excepto por el carbono en forma de grafito
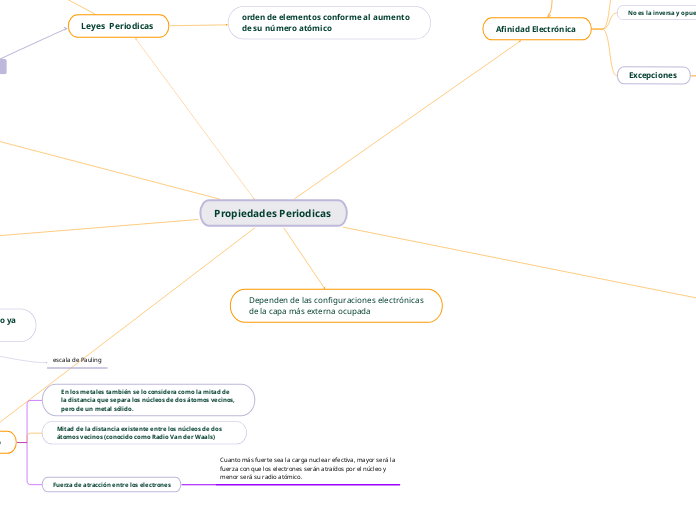
orden de elementos conforme al aumento de su número atómico
Propiedades Periodicas
Energía de ionización (E.I)
Aumenta de izquierda a derecha en un periodo determinado
existen irregularidades
Grupo 6A
En los elementos del grupo 5A (ns2 y np3), los
electrones p se encuentran en tres orbitales diferentes, de acuerdo con la regla de Hund.
En el grupo 6A (ns2 y np4), el electrón adicional debe estar apareado con uno de los tres electrones p. La proximidad entre dos electrones en el mismo orbital provoca gran repulsión, lo que facilita la ionización.
la energías de ionización para los elementos del grupo 6A son menores que las de los elementos del grupo 5A en el mismo periodo
Grupo 3A
Es menor que la de los elementos del grupo 2A porque tienen sólo un electrón en el subnivel externo p (ns2, np1), el cual se encuentra bien apantallado
Apantallamiento: consiste en la disminucion de la fuerza de atracción del núcleo sobre un electrón, debido a la repulsión de otros electrones.
Proceso ENDOTERMICO
mide
Cuán unidos están los electrones en los átomos
Elementos
Alta E.I
ganan electrones para formar aniones
Baja E.I
pierden electrones con facilidad para formar cationes.
Energia minima
necesaria
Para remover un electron de un atomo
En estado gaseoso, en su estado fundamental
Porque no esta influenciado por los átomos vecinos, por lo tanto, no existen fuerzas intermoleculares, lo que facilita la medición de la energía de ionización
Afinidad Electrónica
Excepciones
Grupo 5A
los elementos son ligeramente menos negativos debido a que pueden estar sujetos a la adición de un electrón al conjunto de orbitales semiocupados np, lo cual requiere apareamiento.
N (Nitrógeno)
Grupo 2A
Es muy difícil añadir un electrón al átomo de un metal 2A debido a que su orbital externo s está ocupado
Be (Berilio)
No es la inversa y opuesta de la EI,
Cantidad de energía que se absorbe cuando se añade un electrón a un átomo gaseoso para formar un ion con carga 1-
Por convección se le asigna valor positivo a la energía que se absorbe y valor negativo a la que se libera.
Término preciso y cuantitativo pero difícil de medir
Radio Atómico
Fuerza de atracción entre los electrones
Cuanto más fuerte sea la carga nuclear efectiva, mayor será la fuerza con que los electrones serán atraídos por el núcleo y menor será su radio atómico.
Mitad de la distancia existente entre los núcleos de dos átomos vecinos (conocido como Radio Van der Waals)
En los metales también se lo considera como la mitad de la distancia que separa los núcleos de dos átomos vecinos, pero de un metal sólido.
Electronegatividad
Tendencia relativa de un átomo a atraer los electrones hacia sí cuando se combinan químicamente con otro átomo.
escala de Pauling
Dependen de las configuraciones electrónicas de la capa más externa ocupada
Tabla Periodica
primer modelo
Orden de manera creciente respecto a sus masas atómicas
Moderna
Elementes de acuerdo a sus números atómico y configuración electrónica.