por Israel López hace 2 años
228
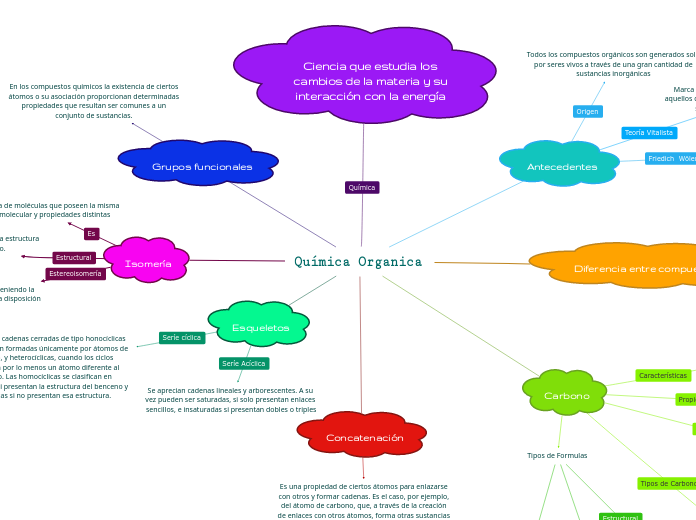
Química Organica
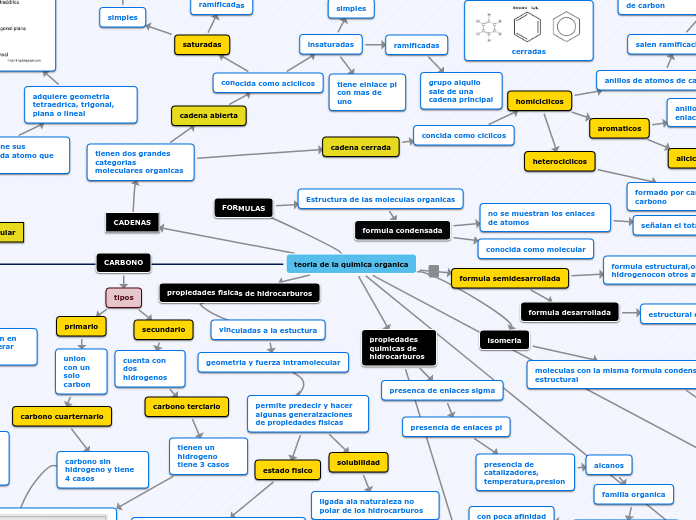
La química orgánica se centra en el estudio de los compuestos que contienen carbono y su capacidad para formar cadenas complejas mediante enlaces con otros átomos. Un aspecto crucial es la isomería, donde compuestos con la misma fórmula molecular presentan diferentes disposiciones espaciales de sus átomos, resultando en propiedades distintas.