jonka Егор Малахов 7 vuotta sitten
582
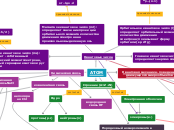
Химия Строение Атома
jonka Егор Малахов 7 vuotta sitten
582

Lisää tämän kaltaisia
Пирометаллургия — восстановление металлов из руд при высоких температурах
металлотермия
алюминотермия Cr2O3+2Al→2Cr+Al2O3
карботермия SnO2+C→Sn+CO2