jonka emilio hernandez 1 vuosi sitten
355
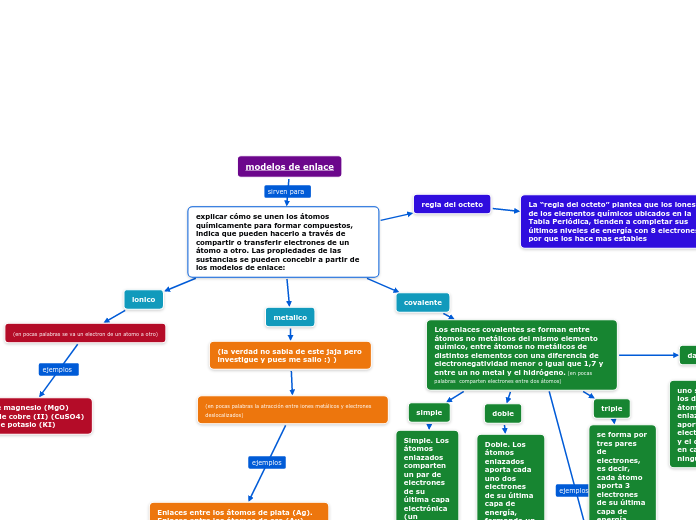
modelos de enlace
jonka emilio hernandez 1 vuosi sitten
355

Lisää tämän kaltaisia
(en pocas palabras la atracción entre iones metálicos y electrones deslocalizados)
Enlaces entre los átomos de plata (Ag). Enlaces entre los átomos de oro (Au). Enlaces entre los átomos de cadmio (Cd).
=Oxígeno puro (O2). O=O (un enlace doble) =Hidrógeno puro (H2). H-H (un enlace simple) =Dióxido de carbono (CO2). O=C=O (dos enlaces dobles) =Agua (H2O). H-O-H (dos enlaces simples) =Ácido clorhídrico (HCl). H-Cl (un enlace simple) =Nitrógeno puro (N2). N≡N (un enlace triple) =Ácido cianhídrico (HCN). H-C≡N (un enlace simple y uno triple)
dativo
uno solo de los dos átomos enlazados aporta dos electrones y el otro, en cambio, ninguno
triple
se forma por tres pares de electrones, es decir, cada átomo aporta 3 electrones de su última capa de energía.
doble
Doble. Los átomos enlazados aporta cada uno dos electrones de su última capa de energía, formando un enlace de dos pares de electrones.
simple
Simple. Los átomos enlazados comparten un par de electrones de su última capa electrónica (un electrón cada uno).
Óxido de magnesio (MgO) Sulfato de cobre (II) (CuSO4) Ioduro de potasio (KI)