jonka Sofi Arenales 5 vuotta sitten
1479
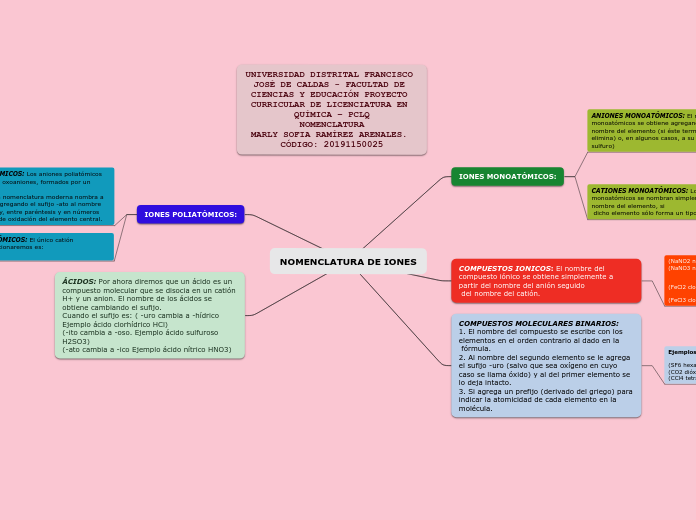
NOMENCLATURA DE IONES
jonka Sofi Arenales 5 vuotta sitten
1479

Lisää tämän kaltaisia
(Fe2+ hierro (II) o ferroso) (Fe3+ hierro (III) o férrico) (Co2+ cobalto (II) o cobaltoso)