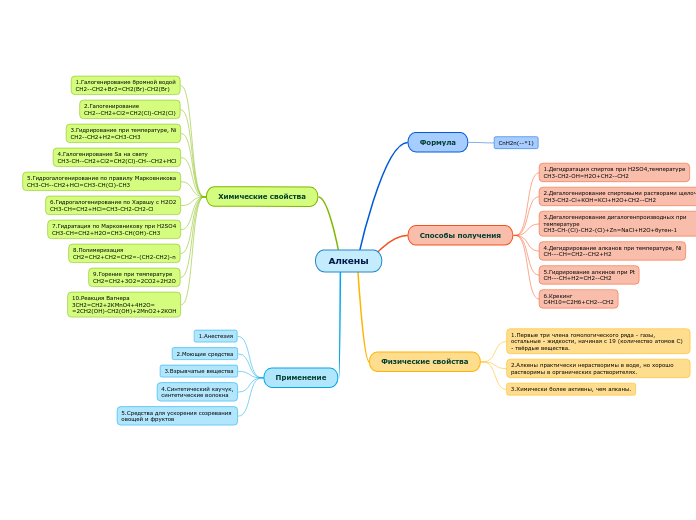
Алкены
Формула
CnH2n(--*1)
Способы получения
1.Дегидратация спиртов при H2SO4,температуре
CH3-CH2-OH=H2O+CH2--CH2
2.Дегалогенирование спиртовыми растворами щелочей
CH3-CH2-Cl+KOH=KCl+H2O+CH2--CH2
3.Дегалогенирование дигалогенпроизводных при температуре
CH3-CH-(Cl)-CH2-(Cl)+Zn=NaCl+H2O+бутен-1
4.Дегидрирование алканов при температуре, Ni
CH---CH=CH2--CH2+H2
5.Гидрирование алкинов при Pt
CH---CH+H2=CH2--CH2
6.Крекинг
C4H10=C2H6+CH2--CH2
Физические свойства
1.Первые три члена гомологического ряда - газы, остальные - жидкости, начиная с 19 (количество атомов С) - твёрдые вещества.
2.Алкены практически нерастворимы в воде, но хорошо растворимы в органических растворителях.
3.Химически более активны, чем алканы.
Химические свойства
1.Галогенирование бромной водой
CH2--CH2+Br2=CH2(Br)-CH2(Br)
2.Галогенирование
CH2--CH2+Cl2=CH2(Cl)-CH2(Cl)
3.Гидрирование при температуре, Ni
CH2--CH2+H2=CH3-CH3
4.Галогенирование Sa на свету
CH3-CH--CH2+Cl2=CH2(Cl)-CH--CH2+HCl
5.Гидрогалогенирование по правилу Марковникова
CH3-CH--CH2+HCl=CH3-CH(Cl)-CH3
6.Гидрогалогенирование по Харашу с H2O2
CH3-CH=CH2+HCl=CH3-CH2-CH2-Cl
7.Гидратация по Марковникову при H2SO4
CH3-CH=CH2+H2O=CH3-CH(OH)-CH3
8.Полимеризация
CH2=CH2+CH2=CH2=-(CH2-CH2)-n
9.Горение при температуре
CH2=CH2+3O2=2CO2+2H2O
10.Реакция Вагнера
3CH2=CH2+2KMnO4+4H2O=
=2CH2(OH)-CH2(OH)+2MnO2+2KOH
Применение
1.Анестезия
2.Моющие средства
3.Взрывчатые вещества
4.Синтетический каучук,
синтетические волокна
5.Средства для ускорения созревания
овощей и фруктов