FARMACOLOGÍA UNIDAD I, II

FARMACOCINETICA
GENERALIDADES
La farmacocinética se refiere a lo que el cuerpo hace con un fármaco.
PROPIEDADES
Absorción
Es el sitio de administración que permite la entrada del fármaco
Distribución
El fármaco puede dejar el torrente sanguíneo de forma reversible y distribuirse en los líquidos intersticiales e intracelulares.
Metabolismo
el fármaco puede biotransformarse a través del metabolismo hepático o de otros tejidos.
Eliminación
El fármaco y sus metabolitos son eliminados del cuerpo en la orina, la bilis o las heces.
VÍAS DE ADMINISTRACIÓN DEL FÁRMACO
Enteral
Oral
Preparaciones con cubierta entérica
Preparaciones de liberación extendida
Sublingual/bucal
Parenteral
Intravenosa
Permite un efecto rápido y un grado máximo de control sobre la cantidad de fármaco administrada.
Intramuscular
Se disuelve lentamente, proporcionando una dosis sostenida a lo largo de un intervalo extendido.
Subcutánea
Puede proporcionar efectos constantes, lentos y sostenidos.
Intradérmica
Consiste en la inyección a la dermis, la capa más vascular de piel debajo de la epidermis
Otros
ABSORCIÓN DE FÁRMACOS
Es la transferencia de un fármaco del sitio de administración al torrente sanguíneo.
Mecanismos de absorción de fármacos a partir de la vía gastrointestinal
Difusión pasiva
El fármaco se mueve de un área de alta concentración a una de menor concentración.
Difusión facilitada
Las proteínas transportadoras sufren cambios conformacionales, lo que permite el paso de fármacos o moléculas endógenas en el interior de las células.
Transporte activo
Los sistemas de transporte activo son selectivos y pueden inhibirse de forma competitiva por otras sustancias cotransportadas.
Endocitosis y exocitosis
Se usa para transportar fármacos de un tamaño excepcionalmente grande a través de la membrana celular.
Factores que influyen sobre la absorción
Efecto del pH sobre la absorción del fármaco
Flujo de sangre al sitio de absorción
Área de superficie total disponible para absorción
Tiempo de contacto en la superficie de absorción
Expresión de glucoproteína P
Biodisponibilidad
Es la velocidad y grado al cual el fármaco administrado alcanza la circulación sistémica
Determinación de biodisponibilidad
Factores que influyen sobre la biodisponibilidad
Metabolismo hepático de primer paso
Solubilidad del fármaco
Inestabilidad química
Naturaleza de la formulación farmacológica
Bioequivalencia y otros tipos de equivalencia
Dos formulaciones farmacológicas son bioequivalentes si muestran una biodisponibilidad comparable y tiempos similares para alcanzar concentraciones sanguíneas máximas
DISTRIBUCIÓN FARMACOLÓGICA
Es el proceso mediante el cual un fármaco deja de forma reversible el torrente sanguíneo y entra al líquido extracelular y a los tejidos.
Flujo de sangre
Por ejemplo, el flujo sanguíneo a los “órganos ricos en vasos” (hígado, cerebro y riñones) es mayor que a los músculos esqueléticos.
Permeabilidad capilar
Se determina por la estructura capilar y por la naturaleza química del fármaco.
Unión de fármacos a las proteínas plasmáticas y los tejidos
Unión a proteínas plasmáticas
Unión a las proteínas tisulares
Lipofilicidad
Los fármacos lipofílicos se mueven con facilidad a través de la mayoría de las membranas biológicas
Volumen de distribución
Se define como el volumen de líquido que se requiere para contener la totalidad del fármaco en el cuerpo a la misma concentración medida en el plasma.
Distribución en los compartimientos de agua en el cuerpo
Compartimiento plasmático
Líquido extracelular
Agua corporal total
Determinación del Vd
Este proceso puede analizarse con mayor facilidad al graficar el logaritmo de la concentración farmacológica en plasma (Cp) frente al tiempo.
Efecto del Vd en la vida media del fármaco
La llegada del fármaco a los órganos de eliminación depende no solo del flujo de sangre, sino también de la fracción del fármaco en plasma.
DEPURACIÓN FARMACOLÓGICA A TRAVÉS DEL METABOLISMO
Vías principales de eliminación
El metabolismo hepatico
La eliminación biliar
La excreción urinaria
Cinética del metabolismo
Cinética de primer orden
La velocidad del metabolismo del fármaco y de eliminación es directamente proporcional a la concentración del fármaco libre y se observa una cinética de primer orden
Cinética de orden cero
Con unos cuantos fármacos, como la aspirina, etanol y fenitoína, las dosis son muy grandes.
Reacciones del metabolismo del fármaco
Fase I
Convierten fármacos lipofílicos en moléculas más polares al introducir o desenmascarar un grupo funcional polar, como –OH o –NH2.
Reacciones de fase I que utilizan el sistema
Nomenclatura
El nombre de la familia está indicado por el número arábigo que sigue a CYP y la letra mayúscula designa la subfamilia, por ejemplo, CYP3A
Especificidad
Debido a que hay muchos genes diferentes que codifican múltiples enzimas, hay muchas isoformas diferentes de P450.
Variabilidad genética
Las variaciones de la actividad P450 pueden alterar la eficacia del fármaco y el riesgo de eventos adversos.
Inductores CYP
Fenobarbital
Rifampicina
Carbamazepina
Inhibidores CYP
Warfarina
Ketoconazol
Omeprazol
Estos incluyen la oxidación de aminas (p. ej., oxidación de catecolaminas o histamina), deshidrogenación de alcohol (p. ej., oxidación de etanol), esterasas (p. ej., metabolismo de la aspirina en el hígado) e hidrólisis (p. ej., procaína).
Fase II
Esta fase consiste de reacciones de conjugación. Si el metabolito de la fase I es suficientemente polar, puede ser excretado por los riñones.
Subtopic

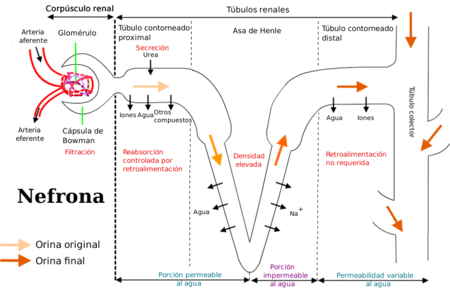
DEPURACIÓN DEL FÁRMACO POR EL RIÑÓN
La eliminación de los fármacos del cuerpo ocurre a través de una variedad de vías; la más importante es la eliminación a través del riñón hacia la orina.
Eliminación renal de un fármaco
Filtración glomerular:
Los fármacos entran al riñón a través de las arterias renales, que se dividen para formar un plexo capilar glomerular.
Las variaciones en la filtración glomerular y la unión proteínica de los fármacos sí afectan este proceso.
Secreción tubular proximal
La secreción ocurre sobre todo en los túbulos proximales por dos sistemas de transporte activo que requieren energía
Uno para aniones (p. ej., formas desprotonadas de ácidos libres)
Uno para cationes (p. ej., formas protonadas de bases débiles).
Reabsorción tubular distal
A medida que un fármaco se mueve hacia el túbulo contorneado distal, su concentración aumenta y excede la del espacio perivascular.
EXCRECIÓN POR OTRAS VÍAS
La excreción farmacológica también puede ocurrir a través
intestinos

bilis
pulmones

leche materna
Los fármacos que no se absorben después de la administración oral de fármacos que se secretan directamente en el intestino o en la bilis se excretan en las heces.
Depuración corporal total
es la suma de todas las depuraciones de los órganos que metabolizan fármacos y de los que los eliminan.
Situaciones clínicas que resultan en cambios en la vida media del fármaco
Cuando un paciente tiene una anormalidad que altera la vida media de un fármaco, se requiere ajustar la dosis.
1) disminución del flujo sanguíneo renal o hepático, por ejemplo, en el choque cardiógeno, la insuficiencia cardiaca o la hemorragia
2) menor capacidad para extraer el fármaco del plasma, por ejemplo, en la enfermedad renal
3) disminución del metabolismo, por ejemplo, cuando un fármaco concomitante inhibe el metabolismo o en la insuficiencia hepática, como en la cirrosis.
DISEÑO Y OPTIMIZACIÓN DEL ESQUEMA DE DOSIFICACIÓN
La selección de un esquema depende de varios factores del paciente y del fármaco, lo que incluye la rapidez con la que tienen que obtenerse las concentraciones terapéuticas de un fármaco.
Esquemas de infusión continua
Concentración plasmática de un fármaco después de infusión IV continua
la concentración plasmática del fármaco se eleva hasta que se alcanza un estado estable
Influencia de la velocidad de infusión sobre la concentración en estado estable
La concentración plasmática en estado estable (Css) es directamente proporcional a la velocidad de infusión.
Tiempo hasta alcanzar la concentración farmacológica en estado estable.
La concentración de un fármaco aumenta desde cero al inicio de la infusión hasta su nivel final en estado estable
Optimización de la dosis
Dosis de mantenimiento
Los fármacos por lo general se administran para mantener una Css dentro de la ventana terapéutica.
Dosis de carga
En ocasiones es necesario obtener con rapidez las concentraciones plasmáticas deseadas (p. ej., en infecciones graves o arritmias).
Ajuste de la dosis
La cantidad de un fármaco administrada para un trastorno determinado se basa en un “paciente promedio”.
Esquemas de dosis fija/tiempo fijo
Las dosis fijas de medicamentos IV u orales administrados a intervalos fijos resultan en fluctuaciones dependientes del tiempo en la concentración circulante del fármaco
Inyecciones IV múltiples
Cuando un fármaco se administra de forma repetida a intervalos regulares, la concentración plasmática aumenta hasta que se alcanza un estado estable
Efecto de la frecuencia de dosificación
Con la administración repetida a intervalos regulares, la concentración plasmática de un fármaco oscila alrededor de una media.
Administraciones orales múltiples
La mayoría de los fármacos administrados de forma ambulatoria son medicamentos orales que se toman a una dosis específica una, dos o más veces al día.

FARMACODINAMÍA
GENERALIDADES
Describe las acciones de un fármaco en el cuerpo
El complejo fármaco-receptor inicia alteraciones en la actividad bioquímica o molecular de una célula mediante un proceso conocido como transducción de señal
TRANSDUCCIÓN DE SEÑAL
Los fármacos actúan como señales y los receptores actúan como detectores de señales.
El complejo fármaco-receptor
Las células tienen muchos tipos diferentes de receptores, cada uno de los cuales es específico para un agonista particular y produce una respuesta única.
Las células cardiacas también contienen receptores muscarínicos que se unen y responden a acetilcolina.
Este concepto es básicamente similar a la formación de complejos entre enzima y sustrato y comparte muchas características comunes, como especificidad del receptor para un agonista determinado
Estados de receptores
La unión de agonistas hace que el equilibrio cambie de R a R* para producir un efecto biológico.
La magnitud del efecto biológico está directamente relacionada con la fracción de R*.
Principales familias de receptores
Un receptor se define como cualquier molécula biológica a la que se une el fármaco y produce una respuesta medible.
Estos receptores pueden dividirse en cuatro familias:
1) canales iónicos con compuerta de ligandos
2) receptores acoplados a proteína G
3) receptores ligados a enzimas
4) receptores intracelulares
Canales iónicos transmembrana con compuerta de ligando
La porción extracelular de los canales iónicos con compuerta de ligandos contiene el sitio de unión al fármaco.
Dependiendo del ion que se conduce a través de estos canales, estos receptores median diversas funciones, lo que incluye neurotransmisión y contracción muscular
Los sitios de unión a fármacos también se encuentran en muchos canales iónicos con compuerta de voltaje donde pueden regular la función del canal
Por ejemplo, los anestésicos locales se unen al canal de sodio con compuerta de voltaje, lo que inhibe la entrada de sodio y disminuye la conducción neuronal.
Receptores transmembrana acoplados a proteína G
La porción extracelular de este receptor contiene el sitio de unión a ligandos y la porción intracelular interactúa (cuando se activa) con una proteína G
Hay muchos tipos de proteínas G (p. ej., Gs, Gi, y Gq), pero todos los tipos están compuestos de tres subunidades proteínicas.
Un efector común, activado por Gs e inhibido por Gi, es la adenililciclasa, que produce el segundo mensajero adenosina monofosfato cíclico
Receptores ligados a enzimas
esta familia de receptores sufre cambios conformacionales cuando es activada por un ligando, lo que resulta en una mayor actividad enzimática intracelular
Receptores intracelulares:
La cuarta familia de receptores difiere considerablemente de las otras tres en que el receptor es completamente intracelular
Los objetivos primarios de los receptores intracelulares activados son factores de transcripción en el núcleo de la célula que regulan la expresión génica.
Características de la transducción de señal
1) la capacidad de amplificar señales pequeñas
2) mecanismos para proteger a la célula de una estimulación excesiva.
Amplificación de señal
Capacidad de amplificar la intensidad de señal y la duración mediante el efecto de cascada de señal
La unión de salbutamol, por ejemplo, solo puede existir por unos cuantos milisegundos, pero las proteínas G activadas subsecuentes pueden durar por cientos de milisegundos.
existe una pequeña reserva funcional en el corazón con insuficiencia, debido a que la mayoría de los receptores deben estar ocupados para obtener la máxima contractilidad.
Desensibilización y regulación negativa de los receptores
El receptor puede desensibilizarse debido a demasiada estimulación agonista
Durante esta fase de recuperación, se dice que los receptores que no responden son “refractarios”.
La regulación al alta de los receptores puede hacer que las células sean más sensibles a los agonistas o más resistentes a los efectos del antagonista.
Un fármaco se denomina “agonista” si se une a un sitio en una proteína receptora y lo activa para iniciar una serie de reacciones
RELACIONES DOSIS-RESPUESTA
La magnitud del efecto del fármaco depende de la sensibilidad del receptor al fármaco y de la concentración del fármaco en el sitio receptor.
Relación dosis graduada-respuesta
A medida que aumenta la concentración de un fármaco, su efecto farmacológico también aumenta de forma gradual hasta que todos los receptores están ocupados.
Potencia
la potencia es una medida de la cantidad del fármaco necesaria para producir un efecto.
Las preparaciones terapéuticas de los fármacos reflejan su potencia.
Debido a que el rango de concentraciones farmacológicas que causan de 1 a 99% de la respuesta máxima suele extenderse por diversas órdenes de magnitud.
Eficacia
La eficacia es la magnitud de respuesta que causa un fármaco cuando interactúa con un receptor.
La respuesta máxima difiere entre los agonistas totales y los parciales, incluso cuando el fármaco ocupa 100% de los receptores.
Efecto de la concentración del fármaco sobre la unión a receptores.
Fármaco + Receptor ⇆ Fármaco – complejo receptor → Efecto biológico.
Relación de la unión del fármaco con el efecto farmacológico.
1) La magnitud de la respuesta es proporcional a la cantidad de receptores ocupados por el fármaco.
2) el E máx ocurre cuando se unen todos los receptores
3) una molécula del fármaco se une a solo una molécula del receptor.
ACTIVIDAD INTRÍNSECA
Un agonista se une a un receptor y produce una respuesta biológica con base en la concentración del agonista, su afinidad por el receptor y, por lo tanto, la fracción de receptores ocupados.
Agonistas totales
Si un fármaco se une al receptor y produce una respuesta biológica máxima que simula la respuesta al ligando endógeno, se trata de un agonista total
Los agonistas totales se unen a un receptor, estabilizan el receptor en su estado activo y se dice que tienen una actividad intrínseca de uno.
Agonistas parciales
A pesar de ello, los agonistas parciales pueden tener una afinidad que es mayor que, menor que o equivalente a la de un agonista total.
A medida que aumenta el número de receptores ocupados por el agonista parcial.
Las vías dopaminérgicas hiperactivas tienden a estar inhibidas por aripiprazol.
Esto puede explicar la capacidad de aripiprazol para mejorar los síntomas de esquizofrenia, con un pequeño riesgo de causar efectos adversos extrapiramidales
Agonistas inversos
Los receptores no unidos son inactivos y requieren de la interacción con un agonista para asumir una conformación activa.
Esto disminuye el número de receptores activados por debajo de lo observado en ausencia del fármaco .
Antagonista
Los antagonistas se unen a un receptor con una alta afinidad pero poseen cero actividad intrínseca.
Antagonistas competitivos
Antagonistas competitivos:
si el antagonista se une al mismo sitio en el receptor que el agonista en una forma reversible, es “competitivo”.
Antagonistas irreversibles
Los antagonistas irreversibles se unen de forma covalente al sitio activo del receptor, con lo que reducen de forma permanente el número de receptores disponibles al agonista.
Antagonistas alostéricos
Un antagonista alostérico se une a un sitio (sitio alostérico) distinto al sitio de unión agonista y previene la activación del receptor por el agonista.
Antagonismo funcional
Un antagonista puede actuar en un receptor completamente separado, iniciando efectos que son funcionalmente opuestos a los del agonista.
RELACIÓN DOSIS-RESPUESTA CUANTAL
Estas respuestas se conocen como respuestas cuantales, debido a que, para cualquier individuo, ocurre ya sea el efecto deseado o no ocurre.
Una respuesta positiva se define como la caída de al menos 5 mm Hg en la presión arterial diastólica.
Índice terapéutico
El IT es una medida de la seguridad del fármaco, debido a que un valor más grande indica un amplio margen entre las dosis que son efectivas y aquellas que son tóxicas.
Utilidad clínica del índice terapéutico
El índice terapéutico de un fármaco se determina usando estudios del fármaco y experiencia clínica acumulada.
En estos casos, el riesgo de experimentar efectos adversos no es tan grande como el riesgo de dejar la enfermedad sin tratar.
Warfarina
Una mayor fracción de los pacientes responde (para este fármaco, la dosis deseada es un aumento de dos a tres veces en la razón normalizada internacional [RNI]) hasta que, eventualmente, todos los pacientes responden
Penicilina
Para fármacos como penicilina es seguro y frecuente administrar dosis en exceso a lo que se requiere como mínimo para lograr una respuesta deseada sin el riesgo de efectos adversos.
BIBLIOGRAFÍA
1.Karen Whalen,PharmD, BCPS, FAPhA.FARMACOLOGÍA. Pharmacology, Seventh ed.Editores. Rajan Radhakrishnan, Carinda
GENERALIDADES
El sistema nervioso autónomo junto con el sistema endocrino, coordina la regulación e integración de las funciones corporales.
El sistema nervioso ejerce sus efectos mediante la rápida transmisión de impulsos eléctricos a lo largo de fibras nerviosas que terminan en las células efectora
Los fármacos que producen su efecto terapéutico
Se conocen como fármacos autónomos
El sistema endocrino envía señales a tejidos objetivo mediante concentraciones variables de hormonas transportadas en la sangre
Los agentes autónomos actúan
Ya sea al estimular porciones del SNA
O al bloquear la acción de los nervios autónomos.

SISTEMA NERVIOSO AUTONOMO

SISTEMA NERVIOSO
Sistema nervioso periférico
Incluye neuronas ubicadas fuera del cerebro y la médula espinal, es decir, cualquier nervio que entra o sale del SNC
Sistema nervioso central
Abarca el cerebro y la médula espinal
Divisiones funcionales dentro del sistema nervioso
División eferente
Sistema autónomo
Entérico
Parasimpático
Simpático
Sistema somático
División aferente
Anatomía del sistema nervioso autónomo
Neuronas eferentes
Las neuronas posgangliónicas
La segunda célula nerviosa, la neurona posgangliónica.
Por lo general no tiene mielina y termina en los órganos efectores
El músculo liso visceral
El músculo cardiaco
Las glándulas exocrinas.
Las neuronas pregangliónicas
Emergen del tronco encefálico o médula espinal y forman una conexión sináptica en los ganglios
Neuronas aferentes
Las neuronas aferentes (fibras) del SNA son importantes en la regulación de reflejos de este sistema
Para enviar una señal al SNC para que influya sobre la rama eferente del sistema de modo que responda.
Neuronas simpáticas
Las neuronas pregangliónicas del sistema simpático provienen de las regiones torácica y lumbar
La médula suprarrenal, en respuesta a la estimulación por la acetilcolina, neurotransmisor gangliónico.
La médula suprarrenal, al igual que los ganglios simpáticos, recibe fibras pregangliónicas del sistema simpático.
Neuronas parasimpáticas
Surgen de los pares craneales
III (oculomotor)
VII (facial)
IX (glosofaríngeo)
X (vago)
Hay una conexión uno a uno entre las neuronas pregangliónicas y posgangliónicas, lo que permite una respuesta discreta de este sistema.
Neuronas entéricas
Es la tercera división del SNA.
Constituye el “cerebro del intestino”.
Funciona de forma independiente
Controla
La motilidad
Las secreciones exocrinas y endocrinas
Microcirculación de las vías gastrointestinales
Funciones del sistema nervioso simpático
La división simpática es responsable de ajustarse en respuesta a situaciones de estrés, como traumatismos, miedo, hipoglucemia, frío y ejercicio
Acciones de los sistemas nerviosos simpático y parasimpático sobre órganos efectores
Glándulas Lacrimales
Estimulación de la lagrima
Glándulas Salivales
Secreción espesa y viscosa , secreción acuosa abundante.
Corazón
Mayor frecuencia : mayor contractilidad Menor frecuencia : menor contractividad
Sistema gastrointestinal
Disminución y aumento de la motilidad
Genitales
Relajación del utero
Vasos sanguíneos
Dilatación
Genitales masculinos
Estimulación de la eyaculación
Uréteres y vejiga
Relajación del detrusor : contracción del trigono y del esfínter
Riñón
Secreción de renina
Medula suprarrenal
Secreción de epinefrina y norepinefrina
OJO
Contracción del musculo radial del irís
Efectos de la estimulación de la división simpática
Es un aumento en la frecuencia cardiaca y presión arterial, movilización de las reservas de energía y aumento en el flujo sanguíneo a los músculos esqueléticos.
La estimulación simpática resulta en la dilatación de las pupilas y los bronquiolos
Respuesta de lucha o huida
El sistema nervioso simpático tiende a funcionar como una unidad y a menudo descarga como un sistema completo, por ejemplo, durante el ejercicio intenso o en reacción al miedo
Funciones del sistema nervioso parasimpático
Es necesario para la vida, debido a que mantiene las funciones corporales esenciales, como la digestión y la eliminación.
A diferencia del sistema simpático, el sistema parasimpático nunca se descarga como un sistema completo.
Las fibras parasimpáticas que inervan órganos específicos como los intestinos, el corazón o el ojo se activan por separado y el sistema afecta a estos órganos de forma individual.
Función del SNC en el control de las funciones autónomas
El SNA es un sistema motor, requiere de alimentación sensorial de las estructuras periféricas para proporcionar información sobre el estado actual del cuerpo.
Estos centros responden a los estímulos al emitir impulsos reflejos eferentes a través del sistema nervioso autónomo.
Arcos reflejos:
una caída en la presión arterial hace que las neuronas sensibles a la presión (barorreceptores en el corazón, vena cava, arco aórtico y senos carótidas.
Emociones y el SNA
Los estímulos que evocan emociones fuertes, como la rabia, el miedo y el placer, pueden modificar las actividades del sistema nervioso autónomo.
Inervación por el sistema nervioso autónomo
Inervación dual
La inervación parasimpática vagal hace más lenta la frecuencia cardiaca y la inervación simpática la aumenta.
A pesar de esta inervación dual, un sistema suele predominar en el control de la actividad de un órgano determinado.
Inervación simpática
Aunque la mayoría de los tejidos recibe inervación dual, algunos órganos efectores como la médula suprarrenal, el riñón, los músculos pilomotores y las glándulas sudoríparas reciben inervación solo del sistema simpático.
Sistema nervioso somático
El sistema nervioso somático eferente difiere del SNA en que una sola neurona motora mielinizada, que se origina en el SNC, viaja directamente al músculo esquelético sin mediación de los ganglios.
Las respuestas en la división somática por lo general son más rápidas que aquellas en el sistema nervioso autónomo.
Resumen de las diferencias entre los nervios simpáticos, parasimpáticos y motores
El sistema nervioso simpático está ampliamente distribuido, inervando prácticamente todos los sistemas efectores en el cuerpo.
La división parasimpática está más circunscrita, con más interacciones uno a uno y los ganglios también están cerca, o en, los órganos que inervan.
El sistema nervioso somático inerva los músculos esqueléticos.
El axón de la neurona motora somática está muy ramificado y cada rama inerva una sola fibra muscular.
La falta de ganglios y la mielinización de los nervios motores permiten una respuesta rápida por el sistema nervioso somático.
SEÑALIZACIÓN QUÍMICA ENTRE CÉLULAS
La neurotransmisión, otro tipo de señalización química incluye la secreción de hormonas y la liberación de mediadores locale
Hormonas
Las células endocrinas especializadas secretan hormonas hacia el torrente sanguíneo
Mediadores locales
Debido a que estas señales químicas se destruyen o eliminan con rapidez, no entran a la sangre y no se distribuyen a lo largo del cuerpo.
Neurotransmisores
La comunicación entre células nerviosas y entre las células nerviosas y órganos efectores ocurre a través de la liberación de señales químicas específicas (neurotransmisores) desde las terminales nerviosas.
Receptores de membrana
Un receptor se define como un sitio de reconocimiento para una sustancia.
Tiene una especificidad de unión y está acoplado a procesos que a la larga evocan una respuesta.
Tipos de neurotransmisores
Norepinefrina (y la epinefrina que está estrechamente relacionada), acetilcolina, dopamina, serotonina, histamina, glutamato y γ-ácido aminobutírico están afectados más a menudo en las acciones de fármacos con utilidad terapéutica.
Acetilcolina
La acetilcolina media la transmisión de los impulsos nerviosos a través de los ganglios autónomos en los sistemas nerviosos tanto simpático como parasimpático.
Es el neurotransmisor en la médula suprarrenal.
Norepinefrina y epinefrina
En el sistema simpático, norepinefrina media la transmisión de los impulsos nerviosos de los nervios posgangliónicos autónomos a los órganos efectores.
Epinefrina secretada por la médula suprarrenal (no las neuronas simpáticas) también actúa como un mensajero químico en los órganos efectores.
Subtopic
TRANSDUCCIÓN DE SEÑAL EN LAS CÉLULAS EFECTORAS
Un neurotransmisor puede considerarse como una señal y un receptor como un detector de señal y transductor
Epinefrina y norepinefrina se unen a los receptores adrenérgicos y acetilcolina se une a los receptores colinérgicos.
La unión de los neurotransmisores con los receptores ionotrópicos afecta directamente la permeabilidad de los iones.
Los receptores metabotrópicos median los efectos de los ligandos al activar un sistema de segundo mensajero en el interior de la célula.

AGONISTAS COLINÉRGICOS
GENERALIDADES
Actúan sobre los receptores activados por acetilcolina
Acetilcolina
Nicotina
Pilocarpina
Los fármacos adrenérgicos actúan sobre receptores estimulados por norepinefrina o epinefrina.
Acción directa
Acción indirecta
Reactivación de colinesterasa
Los fármacos colinérgicos y adrenérgicos actúan ya sea al estimular o al bloquear los receptores del SNA.
LA NEURONA COLINÉRGICA
Neurotransmisión en las neuronas colinérgicas
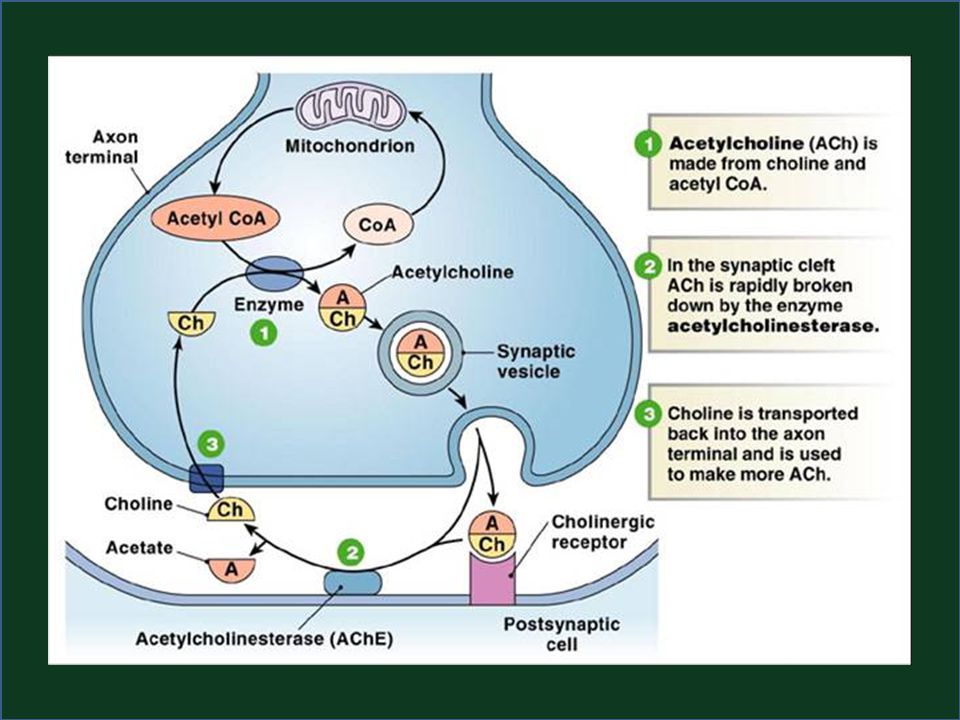
Síntesis de acetilcolina
La colina se transporta del líquido extracelular en el citoplasma de la neurona colinérgica
Almacenamiento de acetilcolina en vesículas
ACh se empaca y almacena en vesículas presinápticas por medio de procesos de transporte activo.
Liberación de acetilcolina
Los canales de calcio sensibles a voltaje en la membrana presináptica se abren, causando un aumento en la concentración de calcio intracelular.
Unión al receptor
Se difunde a lo largo del espacio sináptico y se une a los receptores postsinápticos en la célula
Degradación de acetilcolina
Se termina con rapidez, debido a que la acetilcolinesterasa (AChE) degrada a la ACh en colina y acetato en la hendidura sináptica.
Reciclaje de colina
La colina puede recapturarse por el sistema de captación de alta afinidad, acoplado a sodio.
RECEPTORES COLINÉRGICOS
Receptores muscarínicos
Pertenecen a la clase de receptores acoplados a proteína G
Ubicación de los receptores muscarínicos
Mecanismo de la transducción de la señal de acetilcolina.
Agonistas muscarínicos
Pilocarpina es un agonista muscarínico no selectivo usado para tratar xerostomía y glaucoma.
Receptores nicotínicos
Los receptores nicotínicos de los ganglios autónomos difieren de aquellos en la unión neuromuscular
AGONISTAS COLINÉRGICOS DE ACCIÓN DIRECTA
Acetilcolina
Es un compuesto de amonio cuaternario que no puede penetrar las membranas.
Disminución de la frecuencia cardiaca y el gasto cardiaco
Si se inyecta por vía intravenosa, la ACh produce una breve disminución en la frecuencia cardiaca
Simulan los efectos de la estimulación vagal
Disminución en la presión arterial
la inyección de ACh causa vasodilatación y reduce la presión arterial mediante un mecanismo de acción indirecta
Otras acciones
en las vías gastrointestinales, la acetilcolina aumenta la secreción de saliva, aumenta la secreción de ácido gástrico y estimula las secreciones y la motilidad intestinales.
Betanecol
Es un éster carbamoílo no sustituido estructuralmente relacionado con ACh
Acciones
estimula directamente a los receptores muscarínicos causando una mayor intensidad y tono intestinales.
Usos terapéuticos
se usa para estimular la vejiga atónica
Efectos adversos
puede causar estimulación colinérgica generalizada
Carbacol
Tiene acciones tanto muscarínicas como nicotínicas
Diarrea
Diaforesis
Miosis
Nausea
Urgencia Urinaria
Acciones
tiene profundos efectos sobre los sistemas tanto cardiovascular como gastrointestinal.
Usos terapéuticos
El uso intraocular proporciona miosis para cirugía ocular y reduce la presión intraocular en el tratamiento del glaucoma.
Efectos adversos
Con el uso oftalmológico ocurren pocos efectos adversos debido a falta de penetración sistémica
Pilocarpina
Es una amina terciaria y es estable a la hidrólisis por AChE
Acciones
Produce miosis rápida, contracción de los músculos ciliares y espasmo de la acomodación
Usos terapéuticos
Se usa para tratar glaucoma y es el fármaco de elección para la reducción de urgencia de la presión intraocular.
Efectos adversos
Puede causar visión borrosa, ceguera nocturna y dolor del área de las cejas.
AGONISTAS COLINÉRGICOS DE ACCIÓN INDIRECTA: AGENTES ANTICOLINESTERASA
AChE es una enzima que escinde de forma específica ACh a acetato y colina y, por lo tanto, termina sus acciones
Edrofonio
es el inhibidor prototípico de AChE de acción breve
Fisostigmina
Acciones
tiene una amplia variedad de efectos y estimula no solo los sitios muscarínicos y nicotínicos del SNA
Usos terapéuticos
Se usa en el tratamiento de las sobredosis de fármacos con acciones anticolinérgicas, como atropina.
Efectos adversos
Pueden conducir a convulsiones.
Neostigmina
es un compuesto sintético que también es un éster de ácido carbámico e inhibe de forma reversible AChE
Piridostigmina
Es otro inhibidor de la colinesterasa que se usa en el manejo crónico de la miastenia grave
Tacrina, donepezilo, rivastigmina y galantamina
Las anticolinesterasas como posibles remedios para la pérdida de función cognitiva.
AGONISTAS COLINÉRGICOS DE ACCIÓN INDIRECTA: AGENTES ANTICOLINESTERASA
Ecotiofato
Mecanismo de acción
es un organofosfato que se une de forma covalente mediante su grupo fosfato al sitio activo de AChE
Acciones
Incluyen estimulación colinérgica generalizada, parálisis de la función motora
Usos terapéuticos
incluye el riesgo de cataratas.
TOXICOLOGÍA DE LOS AGENTES ANTICOLINESTERASA
La toxicidad con estos agentes se manifiesta como signos y síntomas muscarínicos y nicotínicos
Reactivación de acetilcolinesterasa
Puede reactivar la AChE inhibida
ANTAGONISTAS COLINÉRGICOS
GENERALIDADES
Es un término general para los agentes que se unen a los colinoceptores (muscarínicos o nicotínicos) y que previenen los efectos de acetilcolina
AGENTES ANTIMUSCARÍNICOS
Conocidos como fármacos anticolinérgicos
Atropina
Es una amina terciaria que se extrae del alcaloide de la belladona
Acciones
Ojo
midriasis (dilatación de la pupila
Gastrointestinal
como un antiespasmódico para reducir la actividad de las vías gastrointestinales.
Cardiovascular
Es una ligera disminución en la frecuencia cardiaca
Secreciones
Bloquea los receptores muscarínicos en las glándulas salivales, produciendo sequedad de la boca
Usos terapéuticos
Oftálmico
ejerce tanto efectos midriáticos
Antiespasmódico
relajar las vías gastrointestinales.
Cardiovascular
se usa para tratar bradicardia de etiologías variables.
Antisecretor
se usa como agente antisecretor para bloquear las secreciones en las vías respiratorias antes de la cirugía
Antídoto para agonistas colinérgicos
Se usa para el tratamiento de intoxicación con organofosfatos
Farmacocinética
Se absorbe con facilidad, se metaboliza parcialmente en el hígado y se elimina sobre todo en la orina.
Efectos adversos
puede causar boca seca, visión borrosa. “ojos arenosos”, taquicardia, retención urinaria y estreñimiento.
Escopolamina
Produce efectos periféricos similares a los de atropina.
Acciones
También tiene el efecto inusual de bloquear la memoria a corto plazo.
Usos terapéuticos
se usa para la prevención de la cinetosis y la náusea y el vómito posoperatorios.
Farmacocinética y efectos adversos
con excepción de la semivida más prolongada.
Tropicamida y ciclopentolato
Estos agentes se usan como soluciones oftálmicas para midriasis y cicloplejía.
Benztropina y trihexifenidilo

AGONISTAS ADRENÉRGICOS
GENERALIDADES
Los fármacos adrenérgicos afectan los receptores que son estimulados por norepinefrina, epinefrina
se conocen como simpatolíticos.
LA NEURONA ADRENÉRGICA
liberan norepinefrina como neurotransmisor primario.
Neurotransmisión en las neuronas adrenérgicas
Síntesis de norepinefrina
Almacenamiento de norepinefrina en las vesículas
Liberación de norepinefrina
Unión a los receptores
Eliminación de norepinefrina
Destinos potenciales de la norepinefrina recapturada
Receptores adrenérgicos
Los tipos de receptor tanto α como β tienen un número de subtipos de receptor específicos
α-adrenoceptores
muestran una respuesta débil al agonista sintético isoproterenol, pero responden a las catecolaminas que ocurren de forma natural, epinefrina y norepinefrina.
Receptores α2
estos receptores se ubican sobre todo en las terminaciones nerviosas presinápticas simpáticas y controlan la liberación de norepinefrina.
β-adrenoceptores
difieren de aquellas de los receptores α y se caracterizan por una fuerte respuesta a isoproterenol, con menos sensibilidad a epinefrina y norepinefrina
CARACTERÍSTICAS DE LOS AGONISTAS ADRENÉRGICOS
El número y la ubicación de las sustituciones OH en el anillo de benceno
La naturaleza del sustituyente en el nitrógeno amino.
Catecolaminas
Alta potencia
las catecolaminas muestran la mayor potencia al activar directamente los receptores α o β.
Inactivación rápida
Tienen solo un breve periodo de acción cuando se administran por vía parenteral y son inactivadas (ineficaces) cuando se administran por vía oral.
Mala penetración en el SNC
Son polares y, por lo tanto, no penetran con facilidad en el SNC.
No catecolaminas
Tienen una vida media más prolongada debido a que no son inactivados por COMT.
Sustituciones en el nitrógeno amino
Es importante para determinar la selectividad β de los agonistas adrenérgicos.
Mecanismo de acción de los agonistas adrenérgicos
Agonistas de acción directa
Agonistas de acción indirecta
Pueden bloquear la recaptación de norepinefrina o causar la liberación de norepinefrina de los grupos o vesículas citoplasmáticos de la neurona adrenérgica
Agonistas de acción mixta
efedrina y su estereoisómero, seudoefedrina, estimulan adrenoceptores directamente y aumentan la liberación de norepinefrina de la neurona adrenérgica
AGONISTAS ADRENÉRGICOS DE ACCIÓN DIRECTA
Epinefrina
Acciones
Cardiovascular
Respiratoria
Hiperglucemia
Lipólisis
Usos terapéuticos
Broncoespasmo
Choque anafiláctico
tratamiento de las reacciones de hipersensibilidad de tipo I
Paro cardiaco
puede usarse para restaurar el ritmo cardiaco en pacientes con paro cardiaco.
Anestesia local
anestésico local y promueve la hemostasia local
Norepinefrina
Acciones cardiovasculares
Vasoconstricción
Reflejo barorreceptor
Usos terapéuticos
Debido a que aumenta su resistencia vascular, por lo tanto, incrementa la presión arterial.
Farmacocinética
se administra por vía IV para el inicio rápido de la acción.
Efectos adversos
No debe administrarse en las venas periféricas, de ser posible.
Isoproterenol
es una catecolamina sintética de acción directa que estimula tanto los receptores adrenérgicos
Dopamina
El precursor metabólico inmediato de norepinefrina, ocurre de forma natural en el SNC en los ganglios basales, donde funciona como un neurotransmisor, así como en la médula suprarrenal
Acciones
Cardiovasculares
Renal y visceral
Usos terapéuticos
Aumenta la presión arterial al estimular los receptores β1 en el corazón para aumentar el gasto cardiaco
Efectos adversos
una sobredosis de dopamina produce los mismos efectos que la estimulación simpática.
Fenoldopam
Se usa como un vasodilatador de acción rápida para tratar la hipertensión grave en pacientes hospitalizados, al actuar sobre las arterias coronarias, arteriolas renales y arterias mesentéricas.
Dobutamina
Se usa para aumentar el gasto cardiaco en la insuficiencia cardiaca tardía
Oximetazolina
se encuentra en muchos aerosoles descongestionantes nasales de venta libre
Fenilefrina
Es un vasoconstrictor que aumenta las presiones arteriales tanto sistólica como diastólica
Salbutamol, metaproterenol y terbutalina
Se usan sobre todo como broncodilatadores y se administran mediante un inhalador de dosis medida
AGONISTAS ADRENÉRGICOS DE ACCIÓN INDIRECTA
Inhiben la recaptación o inhiben la degradación de epinefrina o norepinefrina
Anfetamina
el fármaco también puede aumentar significativamente la presión arterial mediante una acción agonista α1 sobre la vasculatura, así como efectos estimulantes β1 sobre el corazón
Tiramina
es importante debido a que se encuentra en alimentos fermentados, como quesos añejados y vino Chianti.
Cocaína
es única entre los anestésicos locales al tener la capacidad de bloquear el transportador de norepinefrina dependiente de sodio-cloro
ANTAGONISTAS ADRENÉRGICOS
GENERALIDADES
Se unen a los adrenoceptores, pero no desencadenan los efectos intracelulares usuales mediados por receptor
AGENTES BLOQUEADORES α-ADRENÉRGICOS
Los fármacos que bloquean los adrenoceptores α1 afectan profundamente la presión arterial.
Fenoxibenzamina
Es un bloqueador no selectivo, no competitivo de receptores α1 y α2-adrenérgicos.
Acciones
Efectos cardiovasculares
Reversión de epinefrina
Usos terapéuticos
se usa en el tratamiento de la sudoración y la hipertensión relacionadas con feocromocitoma, un tumor secretor de catecolamina de células derivadas de la médula suprarrenal
Efectos adversos
Debe usarse fenoxibenzamina con precaución en pacientes con enfermedad cerebrovascular o cardiovascular.
AGENTES BLOQUEADORES β-ADRENÉRGICOS
Estos fármacos también difieren en su actividad simpaticomimética intrínseca, efectos sobre el SNC
Propranolol: un antagonista β no selectivo
Acciones
Cardiovasculares
Vasoconstricción periférica
Broncoconstricción
Alteraciones en el metabolismo de la glucosa
Usos terapéuticos
Hipertensión
Angina de pecho
Infarto de miocardio
Migraña
Hipertiroidismo
Farmacocinética
Está sujeto al efecto de primer paso y solo alrededor de 25% de una dosis administrada alcanza la circulación.
Efectos adversos
Broncoconstricción
Arritmias
Alteración sexual
Alteraciones metabólicas
Efectos del SNC
Interacciones farmacológicas
Nadolol y timolol: antagonistas β no selectivos
Tratamiento de glaucoma
Acebutolol, atenolol, betaxolol, bisoprolol, esmolol, metoprolol y nebivolol: antagonistas β1 selectivos
Acciones
Reducen la presión arterial en la hipertensión y aumentan la tolerancia al ejercicio en la angina
Usos terapéuticos
Son útiles en pacientes hipertensos con alteración de la función pulmonar.
Labetalol y carvedilol
Son β-bloqueadores no selectivos con acciones de bloqueo α1 concurrentes que producen vasodilatación periférica, con o que reducen la presión arterial.
Uso terapéutico en la hipertensión y la insuficiencia cardiaca
Efectos adverso
la hipotensión ortostática y el mareo
FÁRMACOS QUE AFECTAN LA LIBERACIÓN O CAPTACIÓN DE NEUROTRANSMISORES
Reserpina, un alcaloide vegetal, bloquea el transporte