HIDROCARBUROS
Alifáticos
acíclicos
saturados
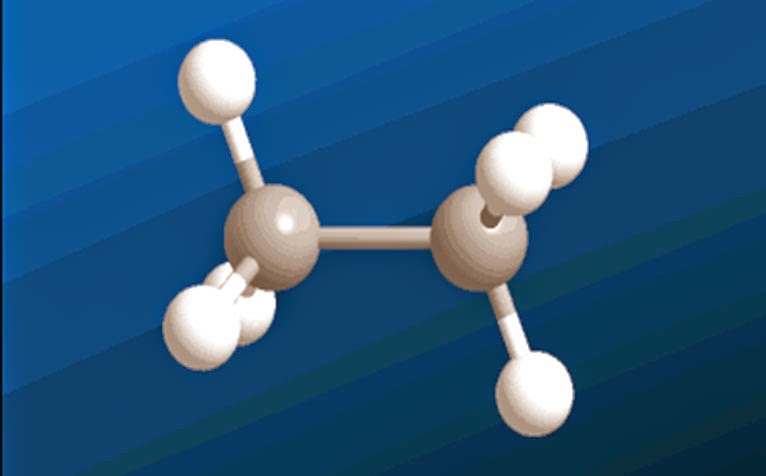
alcanos
tipo de enlace

simple
¿Cómo se nombran estos compuestos?
nombre base

nombre de los sustituyentes.
Se ubican los sustituyentes de la cadena principal
ejemplos
metilo
etilo
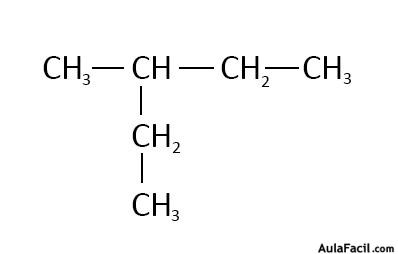
Se numera la cadena principal a fin de ubicar los átomos de carbono donde se unen los sustituyentes
Los sustituyentes de la cadena principal se nombran precedidos por un número que indica el carbono al
que está unido
Composición del nombre
Consideraciones generales
sustituyente se repite más de una vez
prefijo multiplicativo que indica cuantas veces se repite
posiciones donde se ubican dichos sustituyentes
prefijos multiplicativos no se alfabetizan
existe más de una cadena de longitud máxima
elige como cadena principal la más
ramificada
resulte indistinto comenzar la numeración por un extremo o por el otro de la cadena
se numera dando el menor número al sustituyente que se indica primero por orden alfabético
Sustituyentes complejos
sustituyente de la cadena principal es una cadena secundaria a su vez sustituida
Para numerar la cadena secundaria siempre se considera C-1 el que está directamente unido a la cadena principal
Comenzando por este carbono se elige la cadena más larga que servirá de base al nombre de la cadena secundaria. En este caso es de cuatro átomos de carbono
Para nombrar los sustituyentes de la cadena secundaria se siguen las mismas reglas que para los de la cadena principal
El nombre de la cadena secundaria tiene la terminación de un alquilo sustituyente: il
Se encierra el nombre entre paréntesis y se precede por el número que indica el carbono de la cadena principal al que está unido, separando el número del paréntesis con un guión
Se alfabetiza con la primera letra que queda dentro del paréntesis
Nombres comunes
Reglas IUPAC
prefijo iso
prefijos ter y sec
geometría molecular
tetrahedrica
hibridación sp3
¿cómo se pueden escribir? ISOMEROS
Definición
propiedad de aquellos compuestos químicos que tienen la misma fórmula molecular
Fórmulas
fórmula molecular
ver en los ejemplos
fórmula desarrollada
indica todos los enlaces presentes
fórmula condensada
átomos de carbono y de hidrógeno no se
desarrollan
CH3CH2CH2CH3
fórmula de esqueleto
cada línea indica los átomos de carbono enlazados
Propiedades fisicas
son no polares
bajo peso molecular
al aumentar el tamaño de la molécula se incrementa el punto de fusión, ebullición, así como la densidad
insolubles en agua
ejemplos
Metano

CH4
Etano

CH3- CH3
Propano
CH3- CH2- CH3
Butano
n-butano
CH3- CH2- CH2- CH3

isobutano
no saturados
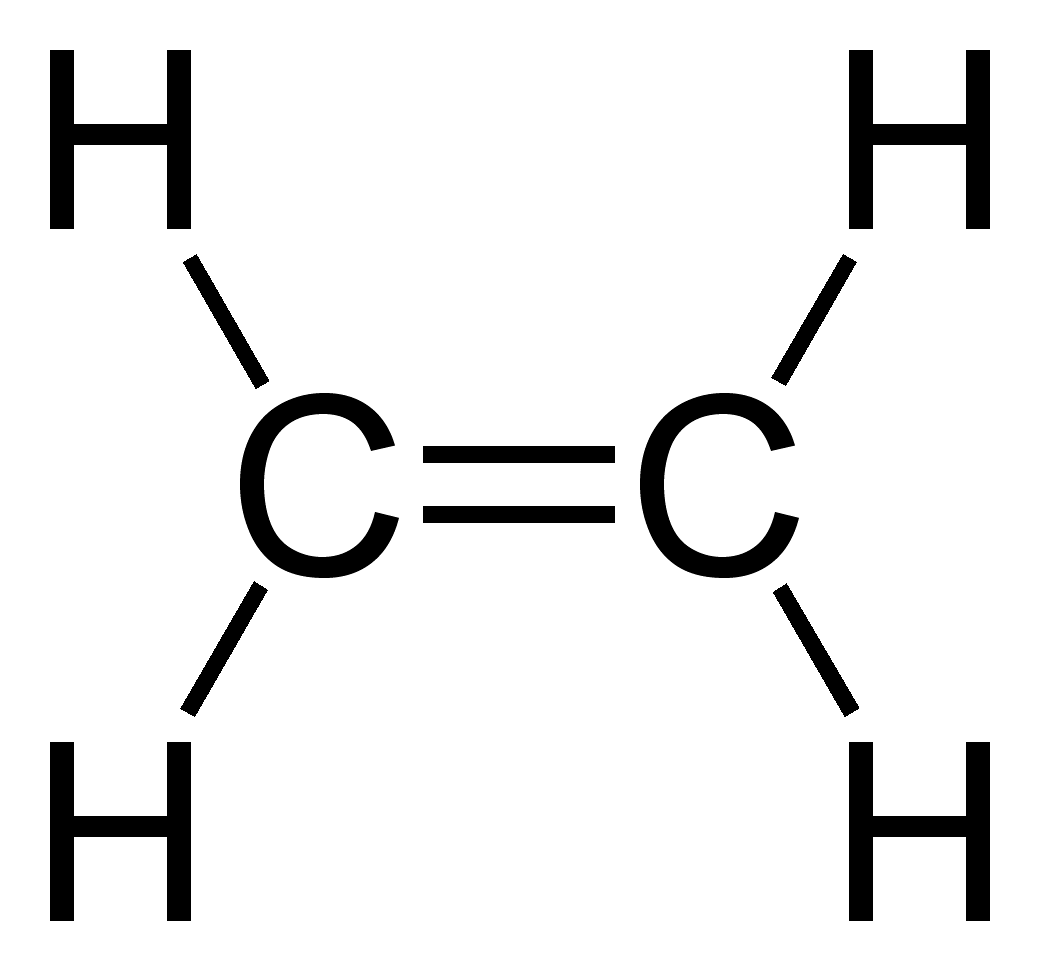
alquenos
tipo de enlace
enlace doble
¿cómo se nombran?
Se determina la cadena de átomos de carbono más larga que contiene el doble enlace y que dará origen al nombre base, cambiando la terminación ano por eno.
Se numera esa cadena de forma de asignar al doble enlace el menor número posible, independientemente de los grupos alquilo ramificantes.
La posición a la que se une el grupo funcional se indica con un número adelante del nombre y separado del mismo con un guión.
El número que indica la posición del grupo funcional es el que corresponde al primero de los dos carbonos de la doble ligadura.
Propiedades físicas
puntos de fusión de los alquenos se incrementan al aumentar el tamaño de la
cadena
densidad de los alquenos es menor a la del agua
solubles en solventes no polares
mas reactivos que los alcanos debido a la presencia del doble enlace
ejemplos

Propeno

Isomería
Isomería estructural de cadena
cambia es la forma de la cadena
lineal
ramificado
Isomería de posición o lugar
cadena es idéntica, varía el sitio donde está el doble enlace
CH2=CH-CH2-CH2-CH2-CH3 (1-HEXENO)
CH3-CH=CH-CH2-CH2-CH3 (2-HEXENO)
CH3-CH2-CH=CH-CH2-CH3 (3-HEXENO)
Isomería geométrica o configuracional CIS-TRANS
sustituyentes iguales se encuentran unidos a carbonos diferentes de la
doble ligadura
cis
trans
ejemplo

geometría molecular
trigonal plana
hibridación sp2
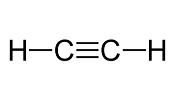
alquinos
tipo de enlace
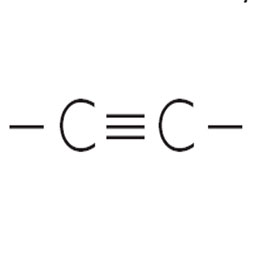
enlace triple
¿cómo se nombran?
los nombramos de la misma menera que los alquenos con la terminación ino
característica del nombre de estos compuestos
Isomeros
Propiedades físicas
débil polaridad
insolubles en solventes polares y solubles en solventes poco o no polares
densidad es menor a la del agua
puntos de fusión y ebullición se incrementan al aumentar el tamaño de la cadena
ejemplos


geometría molecular
lineal
hibridacíon sp
cíclicos
¿qué son?
compuestos cuyos anillos están formados sólo por átomos de carbono
tipos
cicloalcanos

cicloalquenos

cicloalquinos

¿cómo se nombran?
Se antepone la palabra ciclo al nombre del alcano, alqueno o alquino que corresponde según el número de átomos de carbono
En caso que el ciclo esté sustituido se nombran los sustituyentes según las reglas indicadas previamente asignando a la posición sustituida el menor número posible
En caso que el ciclo esté sustituido se nombran los sustituyentes según las reglas indicadas previamente asignando a la posición sustituida el menor número posible
¿QUÉ SON?
Los hidrocarburos son aquellos compuestos constituidos por carbono e hidrógeno

Aromáticos

¿qué son?
Se consideran aromáticos al benceno y a todos los compuestos que se parecen a él en su comportamiento
¿cómo se representan?
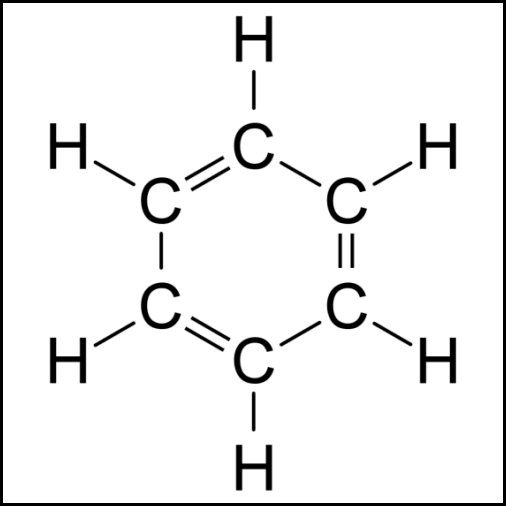
estructuras de Kekulé.
nomenclaturas

monosustituidos
posiciones en el anillo bencénico son equivalentes
sustituyentes pueden ser alquenilos, alquilos o arilos

Disustituidos
dos sustituyentes en el anillo bencénico, sus posiciones relativas se indican mediante números o prefijos
orto-
meta-
para-
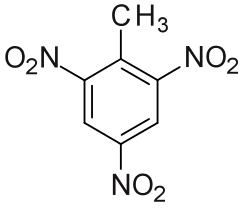
Polisustituidos
dos grupos sustituyentes en el anillo benceno, sus posiciones se deben indicar mediante el uso de números
ejemplos
1-amina-2-yodo benceno
2-yodo anilina / orto-yodo anilina
el anillo benceno como sustituyente se nombra fenilo
cuando está unido a una cadena principal es un fenil

Aromáticos Policíclicos
se indica el número de posición de los sustituyentes, seguido del nombre del sustituyente y seguido del nombre del compuesto
El orden de numeración de estos compuestos es estricta, no se puede alterar y por ende tienen nombres específicos
propiedades fisicas
estados
solidos
liquido
gran estabilidad debido a las múltiples formas resonantes
líquido menos denso que el agua y poco soluble en ella
soluble en otros hidrocarburos
Sus puntos de ebullición son superiores a los hidrocarburos no
aromáticos con igual o semejante peso molecular
