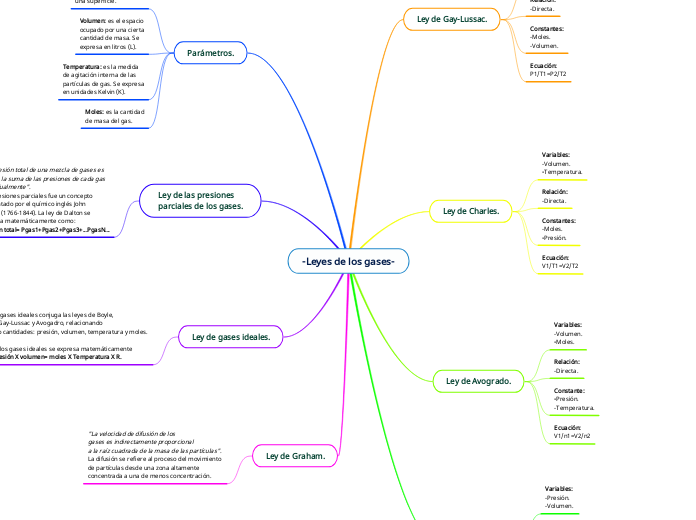
-Leyes de los gases-
Ley de Gay-Lussac.
Variables:
-Temperatura.
-Presión.
Relación:
-Directa.
Constantes:
-Moles.
-Volumen.
Ecuación:
P1/T1=P2/T2
Ley de Charles.
Variables:
-Volumen.
-Temperatura.
Relación:
-Directa.
Constantes:
-Moles.
-Presión.
Ecuación:
V1/T1=V2/T2
Ley de Avogrado.
Variables:
-Volumen.
-Moles.
Relación:
-Directa.
Constante:
-Presión.
-Temperatura.
Ecuación:
V1/n1=V2/n2
Ley de Boyle.
Variables:
-Presión.
-Volumen.
Relación:
-Inversa.
Constantes:
-Moles.
-Temperatura-
Ecuación:
P1V1=P2V2
Parámetros.
Presión: es la cantidad
de fuerza aplicada sobre
una superficie.
Volumen: es el espacio
ocupado por una cierta
cantidad de masa. Se
expresa en litros (L).
Temperatura: es la medida
de agitación interna de las
partículas de gas. Se expresa
en unidades Kelvin (K).
Moles: es la cantidad
de masa del gas.
Ley de las presiones
parciales de los gases.
"La presión total de una mezcla de gases es
igual a la suma de las presiones de cada gas
individualmente".
Las presiones parciales fue un concepto
presentado por el químico inglés John
Dalton (1766-1844). La ley de Dalton se
expresa matemáticamente como:
Presión total= Pgas1+Pgas2+Pgas3+...PgasN...
Ley de gases ideales.
La ley de gases ideales conjuga las leyes de Boyle,
Charles, Gay-Lussac y Avogadro, relacionando
las cuatro cantidades: presión, volumen, temperatura y moles.
La ley de los gases ideales se expresa matemáticamente como: Presión X volumen= moles X Temperatura X R.
Ley de Graham.
"La velocidad de difusión de los
gases es indirectamente proporcional
a la raíz cuadrada de la masa de las partículas".
La difusión se refiere al proceso del movimiento
de partículas desde una zona altamente
concentrada a una de menos concentración.