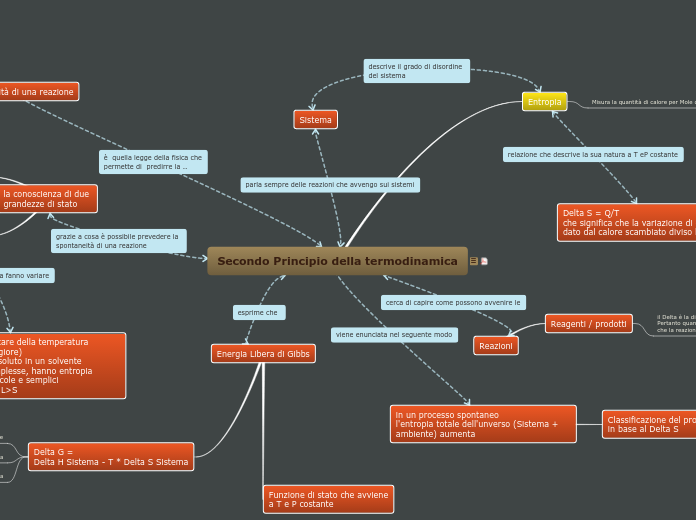
Secondo Principio della termodinamica
Entropia
Misura la quantità di calore per Mole di sostanza
cal/ Kmoli
spontaneità di una reazione
la conoscienza di due
grandezze di stato
Entalpia
entropia
aumenta con l'aumentare della temperatura (energia cinetica maggiore)
quando si scioglie un soluto in un solvente
Molecole grandi e complesse, hanno entropia maggiore di quelle piccole e semplici
Entropia in ordine G>L>S
Delta S = Q/T
che significa che la variazione di entropia è dato dal calore scambiato diviso la T
Sistema
Reazioni
Reagenti / prodotti
il Delta è la differenza fra prodotti e reagenti.
Pertanto quando l'entropia dei reagenti è maggiore vuol dire che la reazione avviene facilmente
in un processo spontaneo
l'entropia totale dell'unverso (Sistema + ambiente) aumenta
Classificazione del processo
in base al Delta S
Spontaneo
In equilibrio
NON Spontaneo
Delta S ambiente =
Delta H sistema / T
Energia Libera di Gibbs
Funzione di stato che avviene
a T e P costante
Delta G =
Delta H Sistema - T * Delta S Sistema
H Energia disponibile
S Energia dispersa
calore
G energlia liberaa
pale/ruote/eliche