Organización
Los seres vivos son complejos y altamente organizados, presentan distintos niveles estructurales
PROPIEDADES QUÍMICAS Y FÍSICAS
químicas: son aquellas que pueden observarse solo cuando una sustancia sufre un cambio en su composición
MAGNITUDES QUÍMICAS
MASA MOLECULAR Y MASA FÓRMULA: para calcular la masa molecular se debe multiplicar la cantidad de átomos de un mismo elemento por su masa atómica y sumarlo al producto de la cantidad de átomos de otro elemento de la misma molécula multiplicado por su masa atómica y repetir la operación como tantos elementos tenga dicha molécula.
MASA ATÓMICA: la escala se basa en un valor arbitrario de exactamente 12 unidades de masa atómica (u.m.a) para un átomo de carbono12. Por tanto, una unidad de masa atómica en esta escala equivale a la doceava parte de la masa de un átomo de carbono1
UNIDAD DE MASA ATÓMICA (u.m.a) se asigna una masa exactamente de 12 u.m.a al isótopo 12C de carbono. En estas unidades la masa del átomo de hidrógeno1 es 1,0080 u.m.a y la del átomo de oxígeno16 es de 15,995 u.m.a.
ÁTOMOS, MOLÉCULAS, IONES, FÓRMULAS
La fórmula de una sustancia indica su composición química. Representa los elementos que contiene y la relación en que se encuentran los átomos.
Un ión es un átomo o grupo de átomos que posee carga eléctrica. Los iones con carga positiva como el Na+ se los denomina cationes, y los iones con carga negativa como el Cl- se los denomina aniones.
Una molécula es la partícula más pequeña de un compuesto o elemento que tiene existencia estable e independiente
La partícula más pequeña de un elemento que mantiene su identidad química a través de todos los cambios químicos y físicos se llama átomo.
físicas: son aquellas que se pueden observar sin cambiar la composición de la sustancia, como lo son el color, olor, sabor, solubilidad, densidad, punto de fusión y ebullición
MAGNITUDES FÍSICAS Y SU MEDIDA
Unidad: Es una cantidad que se adopta como patrón para comparar con ella cantidades de la misma especie. Ejemplo: Cuando decimos que un objeto mide dos metros, estamos indicando que es dos veces mayor que la unidad tomada como patrón, en este caso el metro.
Medir: Es comparar la magnitud con otra similar, llamada unidad, para averiguar cuántas veces la contiene.
Magnitud: Es toda propiedad de los cuerpos que se puede medir. Por ejemplo: temperatura, velocidad, masa, peso,
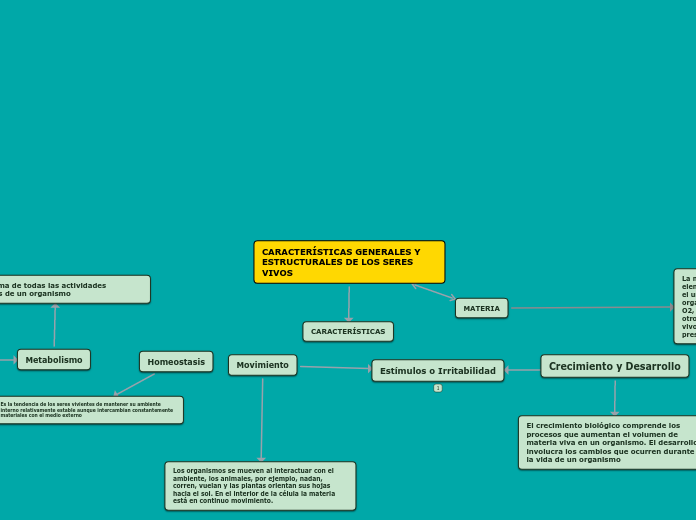
Crecimiento y Desarrollo
El crecimiento biológico comprende los procesos que aumentan el volumen de materia viva en un organismo. El desarrollo involucra los cambios que ocurren durante la vida de un organismo
Movimiento
Los organismos se mueven al interactuar con el ambiente, los animales, por ejemplo, nadan, corren, vuelan y las plantas orientan sus hojas hacia el sol. En el interior de la célula la materia está en continuo movimiento.
Estímulos o Irritabilidad
En la naturaleza se puede observar que diferentes organismos responden a estímulos muy distintos. La capacidad de responder es una característica esencial y casi universal de la vida.
Homeostasis
Es la tendencia de los seres vivientes de mantener su ambiente interno relativamente estable aunque intercambian constantemente materiales con el medio externo
Metabolismo
Es la suma de todas las actividades químicas de un organismo
CARACTERÍSTICAS GENERALES Y ESTRUCTURALES DE LOS SERES VIVOS
MATERIA
La materia del universo se forma de 92 elementos naturales, desde el hidrógeno hasta el uranio. Casi el 98% de la masa de un organismo se compone de apenas 6 elementos: O2, C, H2, N2, Ca y P. Además de estos, hay otros 14 elementos presentes en los seres vivos, denominado oligoelementos por estar presentes en cantidades ínfimas.
La química es la ciencia que describe la materia, sus propiedades físicas y químicas, los cambios que experimenta y las variaciones de energía que acompañan a dichos procesos
Todo el universo está constituido por materia. La Tierra, un auto, una planta, etc.
ESTADOS DE LA MATERIA
El estado gaseoso es menos denso que el líquido y sólido. Un gas ocupa todo el recipiente que lo contiene; las partículas individuales están bastante separadas por ello hay grandes espacios vacíos.
En el estado líquido las partículas individuales están confinadas en un volumen dado. Los líquidos fluyen y toman la forma del recipiente que los contiene, sin que su volumen varíe ya que son difíciles de comprimir
En el estado sólido las sustancias son rígidas y tienen una forma y volumen definido. El volumen de los sólidos “no varía” con los cambios de temperatura y presión.
SUSTANCIAS, COMPUESTOS, ELEMENTOS Y MEZCLAS
Las MEZCLAS son sistemas formados por dos o más sustancias puras, en las que cada sustancia retiene su propia composición y propiedades. La composición de las mezclas puede ser muy diferente.
LAS MEZBLAS SE CLASIFICAN EN:
Las MEZCLAS HETEROGÉNEAS son aquellas en las que presentan 2 o más fases.
MEZCLA HOMOGÉNEA en cualquier porción de la misma que se analice, está formada por una sola fase.
Los ELEMENTOS son sustancias que no se pueden descomponer en otras más simples mediante cambios químicos
Los COMPUESTOS son sustancias puras formadas por dos o más elementos diferentes combinados en una proporción constante. Todos los compuestos pueden originar sustancias más simples, ya sean elementos o compuestos más sencillos.
Una SUSTANCIA es cualquier tipo de materia cuyas muestras tienen composición idéntica, y en condiciones iguales, propiedades idénticas. Una sustancia puede ser un elemento o un compuesto.
CARACTERÍSTICAS