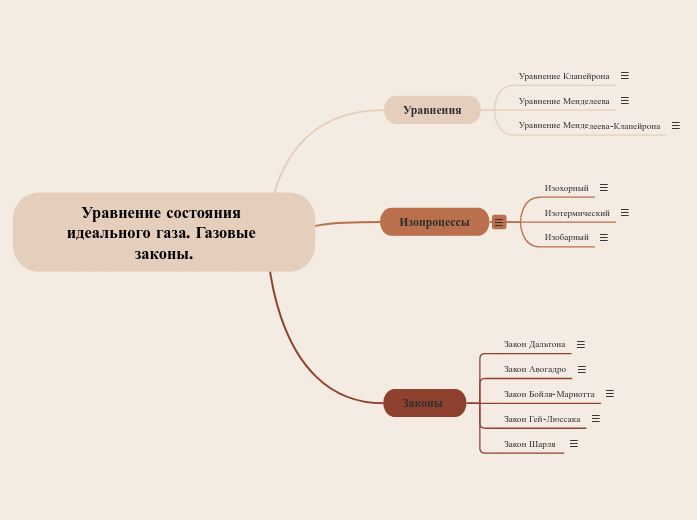
Уравнение состояния идеального газа. Газовые законы.
Законы
Закон Шарля
При данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется - закон Шарля.


Закон Гей-Люссака
Для газа данной массы отношение объема к температуре постоянно, если давление не изменяется - закон Гей-Люссака.



Закон Бойля-Мариотта


Для газа данной массы произведение давления на объём постоянна, если температура газа не меняется - закон Бойля – Мариотта.
Закон Авогадро
Один моль любого газа при нормальных условиях занимает один и тот же объём равный:
V0=0,0224м3/моль=22,4дм3/моль.
Это утверждение называется законом Авогадро
Закон Дальтона
Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.

где pi– парциальное давление i-й компоненты смеси.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равное давлению, которое он будет оказывать, если занимает весь объём при той же температуре.
Изопроцессы
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Изобарный
Равновесное состояние - это состояние, при котором температура и давление во всех точках объёма одинаковы.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Изобара соответствующая более высокому давлению p2 лежит на графике ниже изобары соответствующей более низкому давлению p1.

Изотермический
Что что то ХХХПроцесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Изотерма соответствующая более высокой температуре T1, лежит на графике выше изотермы, соответствующей более низкой температуре T2.

Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии.
Изохорный
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Изохора соответствующая большему объему V2 лежит ниже изохоры, соответствующей меньшему объему V1.

Уравнения
Уравнение Менделеева-Клапейрона
 - уравнение состояния идеального газа.
- уравнение состояния идеального газа.
Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона».
Уравнение Менделеева
Уравнение Менделеева при v = 1 моль

Произведение постоянной Больцмана и постоянной Авогадро называется универсальной газовой постоянной.
Уравнение Клапейрона
Уравнение Клапейрона при m = const: отношение произведения давления и объёма к температуре есть величина постоянная для постоянной массы газа:

Если изменяется какой-либо макроскопический параметр газа постоянной массы, то два других параметра изменятся таким образом, чтобы указанное соотношение осталось постоянным.
Отношение произведения давления и объёма к температуре равно универсальной газовой постоянной для одного моля идеального газа.














 - уравнение состояния идеального газа.
- уравнение состояния идеального газа.





