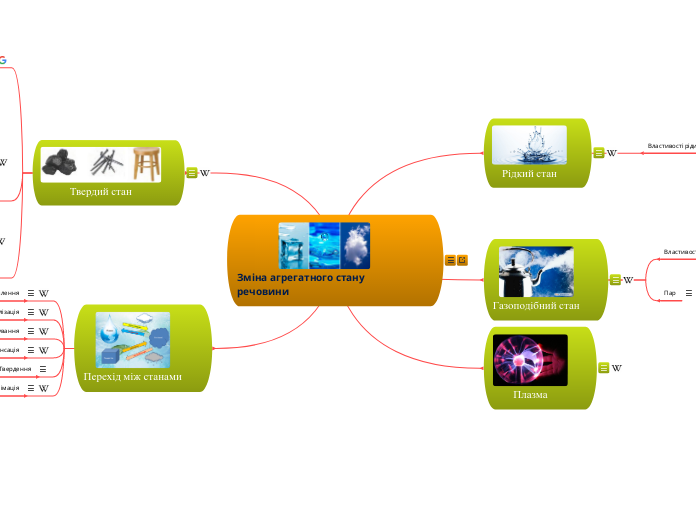
Зміна агрегатного стану речовини
Агрегáтний стан — термодинамічний стан речовини, сильно відмінний за своїми фізичними властивостями від інших станів цієї ж речовини.
Практично будь-яка речовина залежно від фізичних умов може перебувати в трьох агрегатних станах: твердому, рідкому, газоподібному.
Перехід між станами
Сублімація
Сублімація - перехід речовини із твердого стану в газоподібний, оминаючи рідку фазу
Твердення
Тверднення — перехід речовини з рідкого стану в твердий.
Конденсація
Конденса́ція — процес переходу газу або насиченої пари в рідину чи тверде тіло внаслідок охолодження або стиснення їх. Швидкість процесу залежить від зовнішніх умов — тиску, температури, інколи — наявності інших речовин.
Випаровування
Випаро́вування — процес переходу рідини в газоподібний стан, відбувається при будь-якій температурі (на відміну від кипіння, що відбувається при певній температурі).
Кристалізація
Кристаліза́ція - процес виділення з розчину надлишку розчиненої речовини у вигляді кристалів або перехід речовини з газоподібного, рідкого (розчину чи розплаву) або твердого (аморфного) станів у кристалічний.
Плавлення
Пла́влення (топлення) — перехід тіла з твердого стану в рідкий. Зворотний процес — тверднення (кристалізація). Плавлення відбувається з поглинанням теплоти і є фазовим переходом першого роду.
Твердий стан
У твердому агрегатному стані частинки речовин розташовані дуже близько одна до одної. Вони міцно зв'язані між собою, а тому майже не рухаються. Усім твердим речовинам властиві певна форма й об'єм. Форму твердого тіла можна змінити, але його об'єм залишиться незмінним.
Аморфні тіла
Аморфні речовини — це тверді речовини, які не мають дального порядку в розташуванні частинок (атомів, молекул, йонів) і не утворюють кристалічних ґраток, однак ближній порядок в таких речовинах існує.
Аморфні речовини не мають чітко визначеної температури плавлення. За нагрівання вони розм'якають, перетворюючись на в'язку рідину.
Кристали
Кристали — це тверді тіла, у яких атоми або молекули розміщені впорядковано й утворюють періодично повторювану внутрішню структуру.
Властивості твердих тіл
Тверді тіла зберігають об’єм і форму. Річ у тім, що частинки (молекули, атоми, йони) твердих тіл розташовані в положеннях рівноваги. У цих положеннях сила притягання і сила відштовхування між частинками дорівнюють одна одній. У разі спроби збільшити або зменшити відстань між частинками (тобто збільшити або зменшити розмір тіла) виникає міжмолекулярне притягання або відштовхування відповідно. Крім того, частинки твердих тіл практично не пересуваються — вони лише безперервно коливаються.
М'якість
М'якість - властивість тіла, що не протидіє проникненню в нього інших тіл.
Твердість
Твердість - властивість тіла протидіяти проникненню в нього інших тіл.
Міцність
Міцність - властивість тіла не руйнуватися при дії сили.
Крихкість
Крихкість - властивість тіла руйнуватися під дією сили.
Пластичність
Пластичність - властивість тіла змінювати свою форму під дією сили.
Пружність
Пружність - властивість тіла відновлювати форму, після дії на нього сили.
Плазма
Існує ще один агрегатний стан речовини — плазма — частково або повністю йонізований газ, тобто газ, який складається із заряджених частинок (йонів і електронів) та нейтральних атомів і молекул. Наприклад, ртуть перебуває в плазмовому стані в увімкнених ртутних лампах (так звані лампи денного світла). У Всесвіті плазма є найпоширенішим станом речовини.
Газоподібний стан
Газоподібний стан характерний тим, що не зберігає ні форму, ні об'єм. Він заповнює весь доступний об'єм і проникає в будь-які його закутки. Це стан, властивий речовинам із малою густиною. Більшість речовин переходять у газоподібний стан з рідкого або твердого при підвищенні температури.
Пар
На відміну від газу, пара є агрегатним станом, який конденсується і легко переходить в рідину при незначних змінах параметрів стану - пониженні температури або підвищенні тиску. Наприклад водяна пара.
Властивості газів
Ефузія газу.
Ефузія газу – процес витікання газу у вакуумі. Такий процес відбувається при русі газу в пористих середовищах.
Адсорбція газу
Адсорбція газу – процес концентрування молекул газу на поверхні розділу середовищ. Адсорбованість природних газів збільшується зі збільшенням молекулярної маси молекул та зі збільшенням тиску.
Пружність
Характерною властивістю газів є пружність - здатність стискатися і розширятися під впливом тиску і температури, і отже, ці чинники є визначальними параметрами стану газу.
Слабка міжмолекулярна взаємодія речовини в газоподібному стані обумовлює прагнення газу до нескінченного розширення з підвищенням температури. Вельми важливою властивістю газів є їх здатність змішуватися в будь-яких умовах, утворюючи при цьому однорідну - гомогенну суміш.
Рідкий стан
У рідкому стані речовина зберігає об'єм, але не тримає форму. Це означає, що рідина може займати тільки частину об'єму посудини, але вільно перетікати й проникати у всі її закутки. Рідина, на відміну від газу, має добре визначену поверхню. Для більшості речовин рідина — проміжний стан між газом і твердим тілом.
Властивості рідин
Рідина змінює форму, набуваючи форми тієї посудини, в якій міститься, зберігає об’єм і є практично нестисливою.
Ці властивості рідин пояснюються так.
Як і в твердих тілах, частинки в рідинах розташовані впритул одна до одної: середня відстань між ними приблизно дорівнює розмірам самих частинок. Таке щільне упакування частинок спричиняє не тільки збереження об’єму рідини, але й те, що рідину майже неможливо стиснути.
Капілярність
Капіля́рність — явище зміни висоти рівня рідини в капілярах, що пов'язане із змочуванням поверхні мікропор і капілярів рідиною.
Адгезія
Помістимо краплю води на пластинку з полістиролу. Вона приймає форму сплющенної кульки. Таку ж краплю спробуємо помістити на скляну пластинку. Ми побачимо, що на склі вона розтікається. Що ж відбувається з водою? Вся справа в тому, що сили тяжіння діють не тільки між молекулами самої рідини, але і між молекулами різних речовин у поверхневому шарі. Ці сили називаються силами адгезії (від латинського adhaesio – прилипання).
Змішуваність
Рідини можуть розчинятися одна в одній. Ця здатність називається змішуваністю. Якщо помістити в одну посудину дві рідини які змішуються, то в результаті теплового руху їх молекули поступово будуть переходити через межу розділу. В результаті відбудеться змішування. Але не всі рідини можуть змішуватися. Наприклад, вода і олія не змішуються ніколи. А воду і спирт змішати дуже легко.
Поверхневий натяг рідини
Поверхневий натяг рідини – фізична величина, яка характеризує дану рідину і дорівнює відношенню поверхневої енергії до площі поверхні рідини.
Хвилі щільності
Стиснути рідину дуже важко. Але при зміні тиску все ж можливо. І в цьому випадку змінюється її щільність і об’єм. Якщо стиснення відбудеться в одній ділянці рідини, то на інші ділянки воно буде передаватися поступово. Це означає, що в рідині будуть поширюватися пружні хвилі. Якщо щільність змінюється слабо, то отримуємо звукову хвилю. А якщо достатньо сильно, то виникає ударна хвиля.
В’язкість рідини
В'я́зкість або внутрішнє тертя — явище переносу, властивість рідких речовин (рідин і газів) чинити опір переміщенню однієї їх частини відносно іншої.
Текучість рідини
Текучість рідини — здатність частинок рідини сприймати в стані рівноваги найменші дотичні напруги (у зв'язку з чим даний об'єм рідини, що перебуває в стані спокою, завжди набуває форми посудини, в якій вона знаходиться).