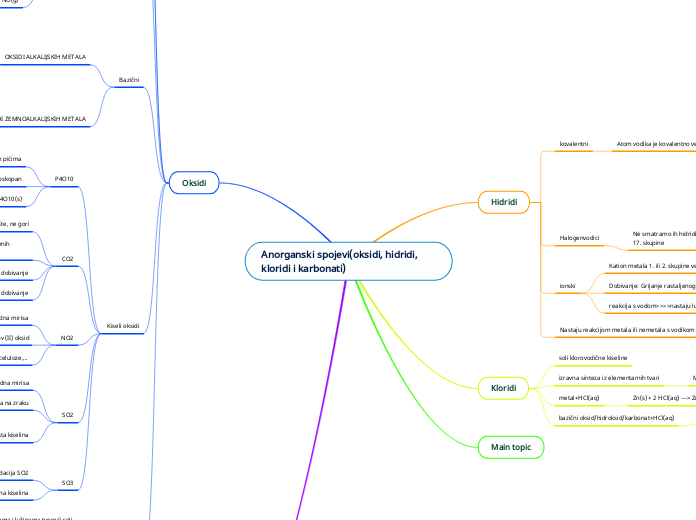
Anorganski spojevi(oksidi, hidridi, kloridi i karbonati)
Karbonati
kalcijev karbonat (CaCO3) u prirodi u različitim mineralima, najrašireniji je vapnenac
bakrov(II) karbonat (CuCO3)
u prirodi: zeleni mineral malahit i plavi mineral azurit
Magnezijev karbonat - MgCO3
koristi se u smjesama za gašenje požara
Natrijev karbonat (soda) - Na2CO3
dobivanje
2 NaHCO3(s) >>>> Na2CO3(s) + H2O(l)
bijela praškasta tvar, topljiva u vodi
Netopljiv u čistoj, a slabo topljiv u vodi sa CO2
CaCO3(s) + H2O(l) + CO2(g) >>>> Ca2(aq) + 2HCO3(aq)
nastanak živog vapna
CaCO3(s) >>△>> CaO(s) + CO2(g)
nastanak gašenog vapna
CaO(s) + H2O(l) >>>> Ca(OH)2(aq)
po kem. sastavu su soli, dobro topljivi u vodi
Oksidi
AMFOTERNI
Al2O3
Stajanje na zraku
4 Al(s)+3 O2(g)>>>2 Al2O3(s)
Reakcija s kiselinom
Al2O3(s) + 6 HCl(aq) >>>> 2 AlCl3(aq) + H2O(l)
Reakcija s lužinom
Al2O3(s) + 2 NaOH(aq) + 3 H2O(l) >>>> 2 Na(Al(OH)4)(aq)
reagiraju s kiselinama i lužinama tvoreći soli
Kiseli oksidi
SO3
topljiv u vodi, nastaje sumporna kiselina
SO3(g)+H20(l)>>>H2SO4(aq)
dobivanje- katalitička oksidacija SO2
2 SO2(g)+O2(g)>>>2 SO3(g)
SO2
topljiv u vodi, nastaje sumporasta kiselina
SO2(g)+H20(l)-->H2SO3(aq)
SO3(g)+H20(l)>>>>H2SO4(aq)
nastajanje- gorenje sumpora na zraku
S(s)+O2(g)>>>>SO2(g)
bezbojan plin, oštra i neugodna mirisa
NO2
upotreba: u pripremi raketnih goriva, izbjeljivanje celuloze,...
topljiv u vodi, nastaje dušična kiselina i dušikov (II) oksid
3 NO2(g)+H2O(l)-->2 HNO3(aq)+NO(g)
vrlo otrovan crvenkasto smeđi plin oštra i neugodna mirisa
CO2
Labaratorijsko dobivanje
CaCO3(s) + 2 HCl(aq)>>>CaCl2(aq)+CO2(g)+H2O(g)
Industrijsko dobivanje
C6H12O6(aq)>>>2 C2H5OH(aq)+2 CO2(g)
Koristi se u aparatima za požar, te je sastavni dio dimnih plinova
Nisko talište i vrelište, ne gori
P4O10
P4(s)+5 O2(g)>>>P4O10(s)
Higroskopan
Koristi se u gaziranim pićima
Bazični
OKSIDI ZEMNOALKALIJSKIH METALA
npr. gorenje Mg na zraku
2 Mg(s)+O2(g)>>>2 MgO(s)
izgaranjem na zraku tvore okside opće formule MO
OKSIDI ALKALIJSKIH METALA
nastaju gorenjem u kisiku ili na zraku
npr. 4 Li(s)+O2(g)>>>2Li2O(s) (oksid)
reakcije s vodom- daju lužine
Li2O(s)+H2O(l)>>>2LiOH(aq)
vrlo reaktivni
Neutralni oksidi
NO
N2(g)+O2(g)>>>2 NO(g)
bezbojan plin, otrovan, netopljiv u H2O
Stvara kisele kiše
CO
CO2(g)+C(s)>>>>2 CO(g)
Nastaje raspadanjem koksa
Koristi se za gorivo
N2O
Nastaje raspadom amonijeva nitrata
NH4NO3(s)>>>N2O(g)+2 H2O(g)
Poznat kao plin smijavac, prije se koristio kao anestetik, sada se koristi u industriji
Ne reagiraju ni sa vodom ni sa kiselinama ni s lužinama
Dijele se n okside metala i nemetala
Najrašireniji spojevi
Main topic
Kloridi
bazični oksid/hidroksid/karbonat+HCl(aq)
metal+HCl(aq)
Zn(s) + 2 HCl(aq) ---> ZnCl2(aq) + H2(g)
izravna sinteza iz elementarnih tvari
Mg(s)+Cl2(g)>>>>MgCl2(s)
soli klorovodične kiseline
Hidridi
Nastaju reakcijom metala ili nemetala s vodikom
ionski
reakcija s vodom>>>>nastaju lužina i vodik
NaH(s)+H2O(l)>>>>NaOH(aq)+H2(g)
Dobivanje: Grijanje rastaljenog metala s vodikom
2 Na(l)+H2(g)>>>2 NaH(s)
Kation metala 1. ili 2. skupine veu se za anion vodika
Formula MH2
Halogenvodici
Ne smatramo ih hidridima, već spojevima vodika s elementima 17. skupine
Formula HX
kovalentni
Atom vodika je kovalentno vezan za atom nemetala
Amonijak(NH3) je najpoznatiji kovalentni hibrid
Bezbojan plin neugodna mirisa
Industrijsko dobivanje: N2(g)+3 H2(g) >>>> 2 NH3(g)
Labaratorijsko dobivanje:2NH4Cl(s)+CaO(s)>>>>2NH3(g)+CaCl2(aq)+ H2O(l)
U reakciji sa klorovodičnom kiselinom daje amonijev klorid
NH3(g) + HCl(g) >>> NH4Cl(s)
Ukućanstvu se koristi u sredstvima za čiščenje