a ABBAS Sami 5 éve
274
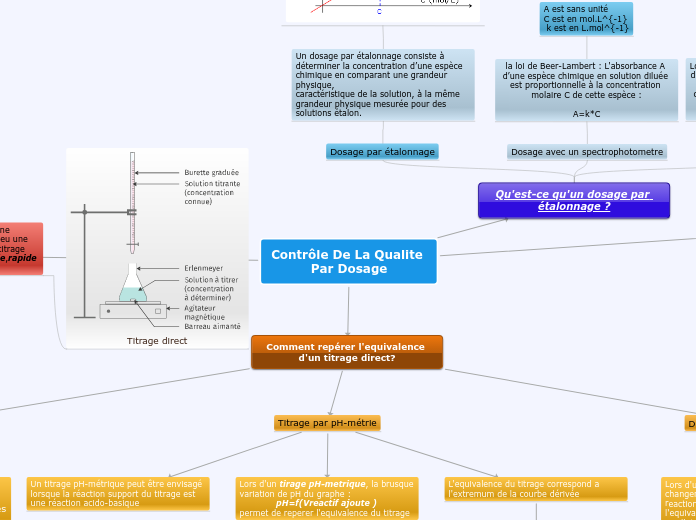
Contrôle de la qualité par dosage
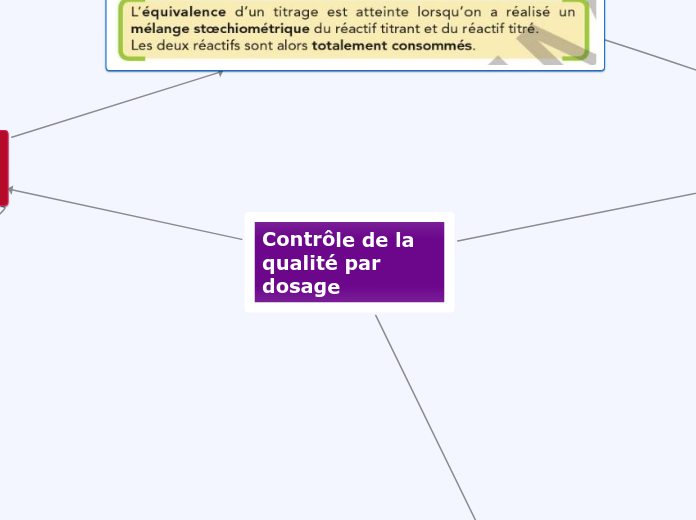
L'équivalence dans une réaction se manifeste par un mélange stoechiométrique, crucial pour les contrôles de qualité par dosage. Différents types de titrage existent pour repérer cette équivalence, notamment par conductimétrie, où la conductivité varie avant et après l'