EL ÓXIDO EN LOS METALES
6- ANÁLISIS DE LOS RESULTADOS
CUADERNO DE CAMPO
DÍA 1 - Domingo 02/10/22: Al principio no hubo nada, pero después de un par de horas, el agua pura y el agua con sal comenzaron a cambiar su color.
DÍA 2 – Lunes 03/10/22: Ya se notaba la coloración del agua y agua con sal, así como la oxidación de los clavos, y el aceite y vinagre solo generaban burbujas.
DÍA 3 – Martes 04/10/22: Ya los calvos del agua y agua con sal, ya estaban muy oxidados, con un color rojizo y cubiertos de oxido. Los clavos de vinagre y aceite comenzaron a volverse plomos.
DÍA 4 – Miércoles 05/10/22: Los clavos del aceite y el vinagre se volvieron plomo oscuro, y los clavos de agua y agua con sal estaban de color rojizo, el oxido cubría la mayor parte de estos, además, había muchos trozos de oxido flotando en los vasos y en el fondo de estos.
GRADOS Y ESCALAS DE OXIDACIÓN
Vaso 4: Vinagre
Grado 8
Grado 4
Grado 10
Vaso 1: Agua
Grado 5
TABLA DE CONTROL
Vaso 4: Vinagre blanco
Día 2.
Aparecieron burbujitas en el vinagre, en el fondo del vaso y cubriendo el clavo.
Día 3.
Se hizo opaco el vinagre, había muchas burbujas que cubrían el clavo. A los lados interiores del vaso, se comenzó a decolorar un tono naranja.
Día 4.
El clavo se volvió plomo oscuro, burbujas flotando, y manchas en los lados internos del vaso.
Vaso 3: Agua con sal
Día 1.
Horas después de introducir el clavo en el vaso, se puede tonar que el agua cambio a un color naranja opaco, además, el clavo comenzó a oxidarse, mostrando un color naranja.
Día 2.
En el fondo, aparecieron pequeños trozos de metal oxidados, el clavo por el oxido se volvió rojizo y el agua se volvió un naranja un poco más oscuro. Además, lo lados del vaso de volvieron color naranja, por los pedazos de oxido.
Día 3.
El color del agua se hizo rojizo, además, que en el fondo, lados, superficie del agua y en el clavo, además este ya esta completamente oxidado, y había una gran cantidad de pequeños trozos de oxido, al punto de que al cubrir al clavo, daban la impresión de que este era mas grueso.
Día 4.
El agua se hizo color rojo oscuro, casi marrón, el calvo estaba muy oxidado, de una color marrón rojizo, por lo lados del vaso, y así como en toda el agua, había un gran cantidad de manchas y trozos de metal oxidado y corroído. El clavo estaba muy oxidado y con una capa de oxido, y el color de este era de una rojo intenso.
Vaso 2: Aceite
Día 1.
Aun no ocurría ninguna cambio.
Día 2.
Aparecieron algunas burbujas al fondo, y en el clavo aparecieron pequeñas manchas.
Día 3.
El aceite cambio su color a un amarillo opaco, las burbujas cubrieron gran parte del espacio, incluso cubriendo el vaso, y el clavo comenzó a ponerse plomo.
Día 4.
El clavo se oxido un poco, se volvió un poco oscuro, y burbujas alrededor.
Vaso 1: Agua
Día 1.
Tan solo 3 horas después, se puede observar el clavo comenzó a oxidarse, además el agua cambio un poco su color a un amarillo opaco.
Día 2.
El agua paso de un amarillo opaco, a un naranja mas llamativo, y el clavo ya estaba cubierto por una capa naranja de oxido. Además, los lados interiores del vaso se comenzó a manchas de naranja por la corrosión.
Día 3.
El agua se hizo naranja, así como la mayor parte del clavo ya esta oxidado y de un color rojo, además de trozos de metal oxidado flotando en el agua.
Día 4.
El agua ahora se veía de un naranja oscuro, gran cantidad de pedazos d oxido flotaba y otros estaba en el fondo, y el clavo estaba completamente oxidado y rodeado de pedazo de metal oxidado.
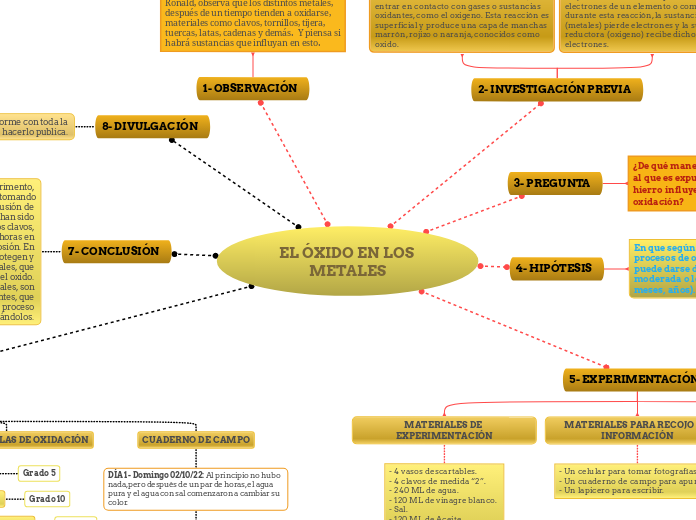
7- CONCLUSIÓN
Durante todo el proceso del experimento, así como el tiempo en que estuve tomando las imágenes, e llegado a la conclusión de que el agua con sal y agua pura han sido los mas rápidos en oxidar los clavos, siendo que solo les tomo tres horas en empezar el proceso de corrosión. En cambio, el aceite y el vinagre, protegen y retrasan la corrosión en los metales, que es la que produce el oxido.
Esto debido a que el agua y las sales, son sustancias o agentes oxidantes, que afectan los mentales, iniciando el proceso de corrosión y oxidándolos.
8- DIVULGACIÓN
Realizar un informe con toda la información recogida y hacerlo publica.
1- OBSERVACIÓN
Ronald, observa que los distintos metales, después de un tiempo tienden a oxidarse, materiales como clavos, tornillos, tijera, tuercas, latas, cadenas y demás. Y piensa si habrá sustancias que influyan en esto.
5- EXPERIMENTACIÓN
PROCEDIMIENTO
1) Marcar la cantidad de sustancia que tendrá cada vaso, unos 120 ML.
2) Señalar o nombrar la sustancia que tendrá casa vaso.
3) Llenar cada vaso con su respectiva sustancia (agua, aceite, agua con sal, vinagre).
4) Introducir cada clavo en cada vaso.
5) Dejarlos reposar y mantener en observación a los vasos por 4 días.
MATERIALES PARA RECOJO DE INFORMACIÓN
- Un celular para tomar fotografías.
- Un cuaderno de campo para apuntes.
- Un lapicero para escribir.
MATERIALES DE EXPERIMENTACIÓN
- 4 vasos descartables.
- 4 clavos de medida “2”.
- 240 ML de agua.
- 120 ML de vinagre blanco.
- Sal.
- 120 ML de Aceite.
- Una chuchara.
4- HIPÓTESIS
En que según las sustancia ,el procesos de oxidación de los clavos puede darse de forma rápida, moderada o lenta (días, semanas, meses, años).
VARIABLES
INTERVINIENTE (LO QUE SE MANTIENE)
- Cantidad de sustancia (ml)
- Material del clavo.
DEPENDIENTE (EFECTO)
- Proceso de oxidación de los clavos.
INDEPENDIENTE (CAUSA)
- Tipos de sustancias.
- Tiempo que toma en oxidar los clavos..
3- PREGUNTA
¿De qué manera el tipo de sustancias al que es expuesto un material de hierro influye en su proceso de oxidación?
2- INVESTIGACIÓN PREVIA
Es el proceso por el cual un átomo, ion o molécula aumenta su estado de oxidación, mejor conocido como la perdida de electrones de un elemento o compuesto, durante esta reacción, la sustancia oxidante (metales) pierde electrones y la sustancia reductora (oxigeno) recibe dichos electrones.
El proceso de oxidación en los metales es una reacción química que se genera cuando material echo de metal como el hierro, entrar en contacto con gases o sustancias oxidantes, como el oxigeno. Esta reacción es superficial y produce una capa de manchas marrón, rojizo o naranja, conocidos como oxido.