a francisco sibaja 5 éve
10930
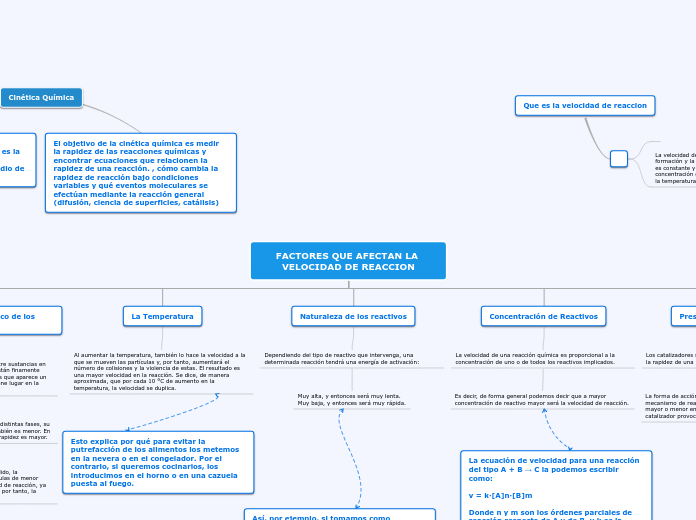
Factores que afectan la Velocidad de Reaccion
La cinética química es una rama de la fisicoquímica que se dedica a estudiar la velocidad de las reacciones químicas y cómo esta puede alterarse bajo diferentes condiciones. Una de las formas más comunes de modificar la rapidez de una reacción es mediante el uso de catalizadores, que son sustancias que, sin participar directamente en la reacción, pueden acelerar o ralentizar el proceso al alterar el mecanismo de reacción.