a Daniela ardila 5 éve
1756
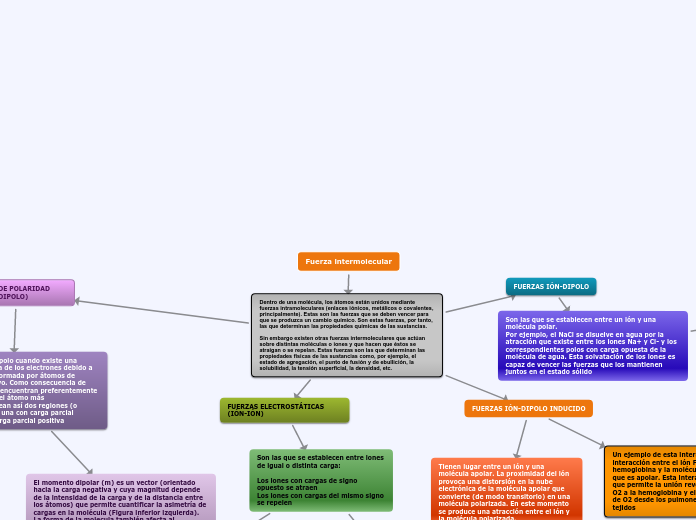
Fuerza intermolecular
Las fuerzas intermoleculares son responsables de las propiedades físicas de las sustancias, influyendo en características como el estado de agregación, puntos de fusión y ebullición, solubilidad, tensión superficial y densidad.