a Fabiola Corituma 5 éve
3205
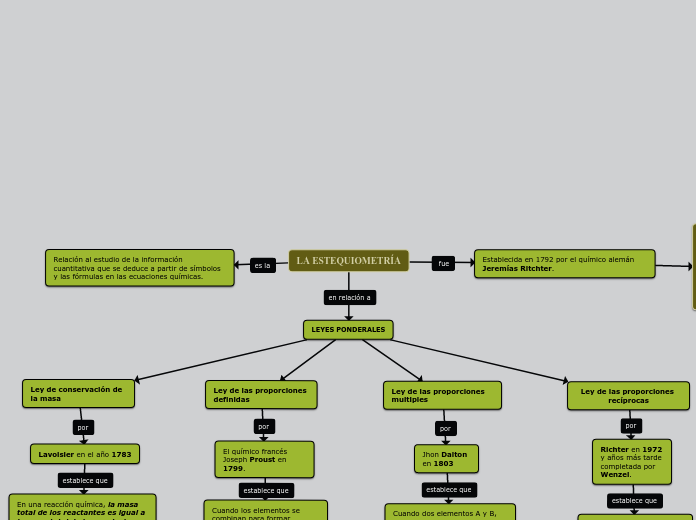
LA ESTEQUIOMETRÍA
Las leyes ponderales establecen principios fundamentales en la química, dictando cómo los elementos se combinan en proporciones definidas para formar compuestos. Antoine Lavoisier, en 1783, propuso la ley de conservación de la masa, que afirma que en una reacción química, la masa total de los reactantes es igual a la masa total de los productos, indicando que la materia no se crea ni se destruye, solo se transforma.