a hayli janeth barrantes quecara 4 éve
1039
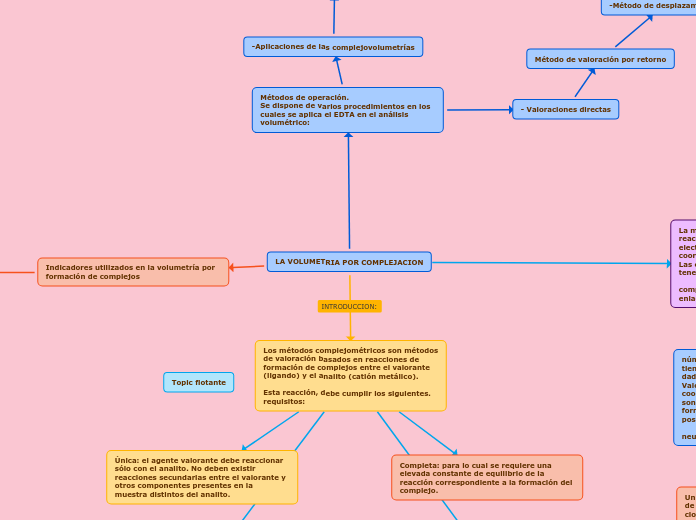
LA VOLUMETRIA POR COMPLEJACION
En el análisis químico, es crucial que las reacciones sean rápidas para evitar demoras prolongadas en los resultados. Es necesario disponer de técnicas precisas que determinen cuándo una reacción ha concluido, lo cual requiere una alta constante de equilibrio.