NOMENCLATURAS INORGANICAS
The letters in PMI stand for the three sections of the PMI chart: Plusses, Minuses, and Interesting things. The I can also stand for Implications on some topics.
Type in your topic.
UTILIDAD
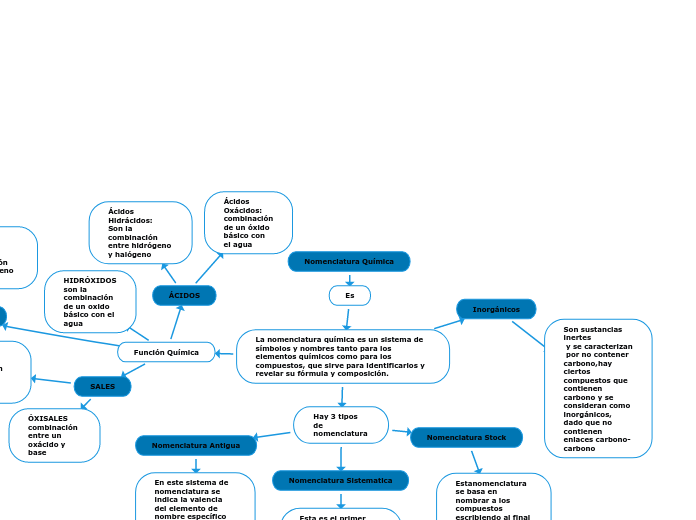
La nomenclatura química para los compuestos inorgánicos, es utilizada para todos aquellos compuestos no carbonados. Los compuestos inorgánicos se clasifican según su función química, siendo las principales funciones: óxidos, bases, ácidos y sales.
NOMENCLATURAS
Add the interesting things or implications that come along with your topic.
.Sales básicas
Se forman cuando en una reacción de neutralización
existe un exceso de hidróxido con respecto al ácido.
Son compuestos que poseen algún grupo OH en su
estructura.
Para formularlas, se escribe primero el catión y luego
los aniones en orden alfabético.
. Nomenclatura sistemática:
Se nombran como las sales neutras con un prefijo
numeral que indica el número de OH- presentes en la sal.
Nomenclatura de STOCK:
Se nombran en orden alfabético anión-hidróxido.
La palabra hidróxido lleva antepuesto un prefijo
que indica el número de hidróxidos presentes en la sal.
Nomenclatura tradicional:
Se nombran como las sales neutras intercalando
la expresión básico precedida de un prefijo
numeral que indique el número de OH- presentes en la sal.
Sales ácidas
Son derivados de oxoácidos polipróticos (con más de
un hidrógeno), en los que se sustituye uno o más
hidrógenos por cationes metálicos.
Se formulan igual que las oxisales, comenzando por el
catión seguido por el oxoanión, que contiene uno o más
hidrógenos.
Nomenclatura sistemática:
Se empieza con prefijonumeralhidrógeno según
el número de hidrógenos que tenga y a
continuación el nombre de la sal correspondiente.
En la actualidad las sales ácidas se nombran
utilizando la nomenclatura de STOCK.
Nomenclatura de STOCK:
Se antepone la palabra hidrógeno al nombre de la
sal, indicando con prefijos numerales el número
de átomos de hidrógenos que quedan sin
sustituir.
Nomenclatura tradicional:
Se nombran como las sales neutras intercalando
la expresión ácido de a continuación el metal
acabado en –ico, o en –oso según su valencia.
Oxisales
Para formular una sal, se escribe en primer lugar el
catión, después el anión, y se intercambian las
valencias.
Si se puede, los subíndices se simplifican y si alguno
vale 1 no se escribe.LA NOMENCLATURA TRADICIONAL EN LOS OXISALES NO ESTA ACEPTADA POR LA IUPAC
Oxoácidos u oxiácidos
Los ácidos u oxiácidos son compuestos ternarios,
formados por tres elementos distintos: hidrógeno, que
actúa con su estado de oxidación +1, oxígeno, que
siempre actúa con estado de oxidación -2 y un tercer
elemento de la tabla periódica, que actuará con un
estado de oxidación positivo.
La fórmula de los oxiácidos empieza por el símbolo del
hidrógeno, a continuación el símbolo del elemento y,
finalmente, el símbolo del oxígeno, cada uno con un
subíndice de forma que la suma de los estados de
oxidación de los átomos de la fórmula sea 0.
Hidróxidos
Aunque formados por tres elementos distintos, los
hidróxidos se comportan como compuestos binarios, ya
que el ión negativo o anión hidróxido (OH-
) actúa
siempre como una unidad conjunta. Todos reciben la
denominación hidróxido de... y se forman con un
metal.
Para formular los hidróxidos, escribimos en primer
lugar el símbolo del metal, a continuación el grupo
hidróxido, entre paréntesis, que llevará como subíndice
la valencia del metal.
Si la valencia es 1 no se necesita escribirla ni poner los
paréntesis.
Sales binarias
Las sales binarias son combinaciones de un metal con
un no metal o dos no metales entre sí.
En los compuestos de un metal y un no metal, el no
metal actúa siempre con su estado de oxidación
negativo.
Para formularlos, se escribe en primer lugar el símbolo
químico del metal, a continuación el del no metal y se
intercambian las valencias.
Si ambas valencias son divisibles por el mismo número,
se realiza la división y se coloca el cociente
Hidruros no metálicos (hidrácidos)
Los hidrácidos resultan de la combinación del
hidrógeno con los haluros o los anfígenos, elementos
del grupo del oxígeno o del grupo del flúor:
Oxígeno, azufre, selenio y teluro o flúor, cloro, bromo y
iodo.
El hidrógeno actúa con estado de oxidación +1 y el otro
elemento con su estado de oxidación negativo.
Se formulan escribiendo en primer lugar el símbolo del
hidrógeno, que llevará como subíndice la valencia del
otro elemento, seguido del símbolo de ese segundo
elemento.NO SE UTILIZA STOCK
Hidruros no metálicos
Los hidruros volátiles son compuestos gaseosos que resultan de la combinación del hidrógeno con los elementos de los grupos del nitrógeno, del carbono o el boro.
El hidrógeno actúa con estado de oxidación +1 y el otro elemento con su estado de oxidación negativo. Se formulan escribiendo en phimer lugar el símbolo del elemento correspondiente y después el simbolo del hidrógeno, que llevará como subíndice la valencia del elemento.
Hidruros metálicos
Los hidruros metálicos resultan de la combinación del
hidrógeno con un metal. El hidrógeno actúa con estado
de oxidación -1. Se formulan escribiendo en primer
lugar el símbolo del metal correspondiente y después el
símbolo del hidrógeno, que llevará como subíndice la
valencia del metal
Peróxidos y superóxidos
Un peróxido es la combinación de un metal o el
hidrógeno con el grupo peróxido (O2
-2). Si la valencia es par, se simplifican ambos subíndices y no se escribe
el subíndice 1.
Óxidos
Un óxido es la combinación de cualquier elemento con
el oxígeno. Todos reciben la denominación óxido de,
salvo el compuesto con hidrógeno, que se llama agua.
Para formular los óxidos, escribimos en primer lugar el
elemento del que se desea formular el óxido, con el
subíndice 2 y a continuación el símbolo del oxígeno,
que llevará como subíndice la valencia del elemento.
Cationes hipo -oso
Para formular un ion que empiezan por hipo y
terminan en -oso, se procede como en los -ico pero
suponiendo que el elemento se ha desplazado cuatro
lugares a la izquierda en el sistema periódico.
Excepciones: Los elementos del grupo 17 se suponen
situados en el 15. Los elementos del grupo 7 se
suponen situados en el 6.
Cationes per –ico
Para formular un ion que empieza por per y termina
por -ico se procede como los terminados en -ico pero
suponiendo que el elemento se ha desplazado dos
lugares a la derecha de la tabla periódica.
Excepciones: Los elementos del grupo 7 y 17 no se
desplazan y los elementos del 6 y 16 sólo se desplazan
un lugar. (Ningún elemento tiene valencia 8)
Cationes -oso
Para formular un ion terminado en -oso, se procede
como en los -ico pero suponiendo que el elemento se
ha desplazado dos lugares a la izquierda en el sistema
periódico.
Excepciones: Se mantienen las excepciones.
Cationes -ico
Para formular un ion terminado en -ico, se escribe el
símbolo del elemento con tantas cargas positivas como
indica la última cifra del número de grupo.
Excepciones: Los elementos del grupo 17 se suponen
situados en el 15. Los elementos del grupo 7 se
suponen situados en el 6.
Aniones Meta
El prefijo meta no significa nada, el ión se formula
como si este prefijo no existiera.
Sólo tiene significado en el fosfato y el ortofosfato.
Decimos FOSFATO y formulamos ORTOFOSFATO,
decimos METAFOSFATO y formulamos FOSFATO
Aniones Piro
Los iones que comienzan por piro, se formulan
como si fueran un ion di+orto
Aniones Orto
Para formular los iones que comienzan por orto, se
formulan como los anteriores, pero añadiendo un
ion óxido más de los necesarios.
Excepciones: El ortofosfato es llamado fosfato
(igual para el As, Sb, ya sea ato, ito…).
El fosfato, se nombra metafosfato.
Aniones Di, tre, tetra…
Se formulan como los anteriores, pero escribiendo
tantos átomos como indique el prefijo.
Aniones hipo -ito
Para formular los iones que empiezan por hipo y
terminan por -ito se procede como los terminados en
-ato pero suponiendo que el elemento se ha
desplazado cuatro lugares a la izquierda de la tabla
periódica.
Excepciones: Los elementos del grupo 17 se suponen
situados en el 15. Los elementos del grupo 7 se
suponen situados en el 6.
Aniones per –ato
Para formular un ion que empieza por per y termina
por -ato se procede como los terminados en -ato pero
suponiendo que el elemento se ha desplazado dos
lugares a la derecha de la tabla periódica.
Excepciones: Los elementos del grupo 7 y 17 no se
desplazan y los elementos del 6 y 16 sólo se desplazan
un lugar. (Ningún elemento tiene valencia 8
Aniones -ito
Para formular los iones terminados en -ito se procede
como los terminados en -ato pero suponiendo que el
elemento se ha desplazado dos lugares a la izquierda
de la tabla periódica.
Excepciones: Los elementos del grupo 17 se suponen
situados en el 15. Los elementos del grupo 7 se
suponen situados en el 6.
Aniones -ato
Para formular un ion terminado en -ato se escribe el
símbolo del elemento, con tantas cargas positivas
corno indica la última cifra del grupo, y a continuación,
se añaden tantos iones óxido (O
-2
) como sean
necesarios para que el conjunto resulte con una o dos
cargas negativas.
Excepciones: Los elementos del grupo 17 se suponen
situados en el 15. Los elementos del grupo 7 se
suponen situados en el 6.
Aniones -uro
Para formular un ion terminado en -uro se escribe el
símbolo del elemento con tantas cargas negativas
como resulte de restarle ocho a la última cifra del
grupo.
IUPAC
Add the drawbacks of your topic.
La Unión Internacional de
Química Pura y Aplicada
(IUPAC) en 1994 defina la
valencia como: El máximo número
de átomos univalentes (hidrógeno
o cloro) que pueden combinarse
con un átomo del elemento en
consideración.
NOMENCLATURA SISTEMÁTICA
Utiliza prefijos numerales que indican los
átomos que hay en la molécula.
Mono- solo una valencia,bi- dos valencias, tri- tres valencias,tetra- cuatro valencias,penta-cinco valencias, hexa-seis valencias,hepta-siete valencias, octa- ocho valencias.
NOMENCLATURA STOCK
La valencia del elemento se indica con números
romanos. Si esta es única no se indica.
Oxido de cloro VIII,Oxido de cloro V,Oxido de carbono V
NOMENCLATURA TRADICIONAL
Utiliza las terminaciones –ico -oso,- per-ico, hipooso para indicar la valencia del elemento.
EJEMPLOS
Oxido férrico, oxido ferroso, oxido aurico,oxido mercúrico
HISTORIA
Add the advantages of your topic.
las fórmulas de las
sustancias consistirán en una combinación de letras y
números que indican el número de átomos de cada
elemento
A principios del siglo XIX, Berzelius asigna a cada
elemento un símbolo que coincide con la inicial del
nombre en latín.
Lavoisier publica su Tratado Elemental de
Química en el que expone de forma organizada y
sistemática la nueva nomenclatura.
En 1780 Lavoisier junto con , Guyton de Morveau, Berthollet y
Fourcony inician la creación de un sistema de
nomenclatura más lógico y racional que el de los alquimistas