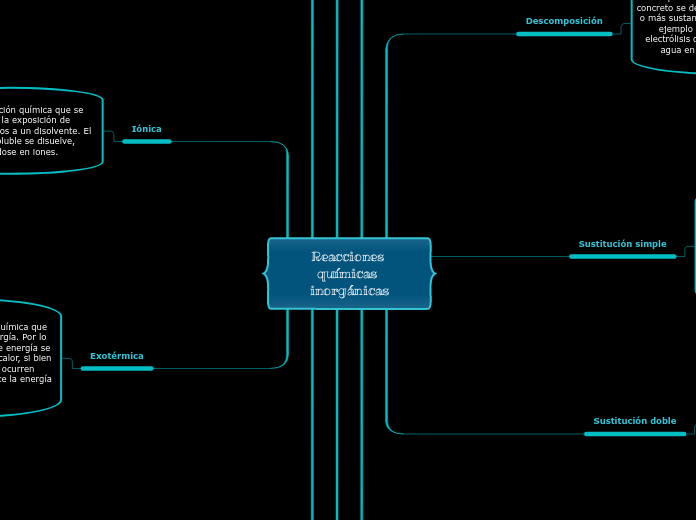
Reacciones químicas inorgánicas
Neutralización
Esta reacción química se produce cuando una sustancia básica y otra ácida interaccionan, de tal manera que se neutralizan formando un compuesto neutro y agua.
Reacción ácido-base del HCl con NaOH
HCl(ac) + NaOH(ac) → NaCl(ac) + H2O(liq) ácido+ base → sal + agua HNO3 + Al(OH)3 → Al(NO3)3 + H2O
Ayudan a corregir el pH de los efluentes industriales y dejarlos en valores aceptables antes de desecharlos. También hay antiácidos estomacales, compuestos de bases, que a través de la neutralización disminuyen la acidez estomacal.
Endotérmica
Este tipo de reacciones químicas, son aquellas en la que la interacción entre elementos absorbe energía del medio, siendo el producto final mucho más enérgico que los reactivos.
Descomposición química del agua: 2H2O + energía → 2 H2 + O2 Descomposición del carbonato de calcio: CaCO3 (s) → CO2 (s)+ CaCO (s)
Se utilizan como reguladores de temperatura, ya que permiten absorber el calor de otra reacción que se da en el ambiente, y es gracias a ellas que podemos regular las temperaturas de nuestro automóvil por ejemplo a través del refrigerante, ya que éste tipo de reacciones absorben el calor
Ejemplos de Reacciones Endotérmica:
Exotérmica
Se trata de una reacción química que provoca la emisión de energía. Por lo general, estas emisiones de energía se dan al menos en forma de calor, si bien en los casos en los que ocurren explosiones también aparece la energía cinética.
Reacción de combustión: C + O2 → CO2 + calor
Reacción de oxidación: 4 Fe + 3 O2 → 2 Fe2O3 + calor
Reacción de neutralización: HCl + NaOH → NaCl + H2O + calor
Se forman los productos, cloruro de sodio (sal) y agua, la disolución se calienta
Iónica
Es aquella reacción química que se produce por la exposición de compuestos iónicos a un disolvente. El compuesto soluble se disuelve, disociándose en iones.
Disolución acuosa: Ag+(ac) + Cl-(ac) → AgCl(s)
H+(ac) + OH-(ac) → H2O(l)
Ba+2(ac) + SO4-2(ac) → BaSO4(s)
Usados en un principio en aplicaciones electroquímicas, presentan una gran utilidad como disolventes, a la vez que han dado excepcionales resultados en otras aplicaciones donde constituyen un nuevo medio para las reacciones químicas. Todas sus aplicaciones están basadas en sus propiedades únicas entre las que destacan su presión de vapor prácticamente nula y una alta estabilidad química y térmica que permite su reutilización.
Ejemplos de Reacciones Exotérmica:
Combustión
Esta reacción genera un tipo de oxidación extremadamente rápida y enérgica, en el que una sustancia orgánica reacciona con oxígeno. Esta reacción genera energía y puede generar llamas y que suele tener como resultado un producto en forma de gas.
Combustión del metano: CH4 + 2O2 → CO2 + 2H2O
Combustión del etano: 2C2H6 + 7O2 → 4CO2 + 6H2O
Combustión del propano: C3H8 + 5O2 → 3CO2 + 4H2O
Útiles para la industria de procesos ya que permiten disponer de energía para otros usos y generalmente se realizan en equipos de proceso como hornos, calderas y todo tipo de cámaras de combustión.
Nucleares
Reacción química en la que se ínsita una modificación no de los electrones de los átomos, sino de su núcleo. Esta combinación o fragmentación va a provocar un elevado nivel de energía.
Serie Radioactiva del Torio: 232Th → 228Ra → 228Ac → 228Th → 224Ra → 220Rn → 216Po → 212Pb → 212Bi → 212Po → 208Pb Serie del Uranio: 238U → 234Th → 234Pa → 234U → 230Th → 226Ra → 222Rn → 218Po → 218At → 218Rn → 214Pb → 214Bi → 214Po → 210Tl → 210Pb → 210Bi → 210Po → 206Tl → 206Pb
El ciclo nuclear del combustible.
Cinética (utilizada dentro de la química de mecanismos)
Usos dentro de la geología, biología y ciencias forenses.
Resonancia Magnética Nuclear (RMN)
Ejemplos de Reacciones Combustión:
Redox
Es la reacción química en que existe intercambio de electrones. En las reacciones de oxidación uno de compuestos pierde electrones en favor del otro, oxidándose. El otro compuesto se reduciría al aumentar su número de electrones.
Semireacciones:
Zn → Zn+2 + 2e-
2 Ag+ + 2e- → 2Ag
Reacción global:
Zn + 2 Ag+ + 2e- → Zn+2 + 2Ag + 2e-
Aplicación industrial de purificar y encontrar sustancias, ya que constituyen el principio de funcionamiento de las pilas eléctricas y se emplean para refinar electroquímicamente determinados metales
Ejemplos de Reacciones Redox:
Sustitución doble
Esta reacción se crea entre dos compuestos y equivalen a un intercambio o sustitución mutua de elementos que da lugar a dos nuevas sustancias químicamente análogas a las primeras.
Reacciones de Precipitación:
AgNO3 + NaCl → AgCl + NaNO3 Otros ejemplos:
CaF2 + H2SO4 → CaSO4 + 2HF
CaCO3 + 2HCI → H2CO3 + CaCI2
KOH + CINH4 → KCI + NH3 + H2O
Soluciones incoloras, pero el producto yoduro de plomo, es un sólido de especular color amarillo que se precipita de la solución.
Aplicaiones
Ejemplos de Reacciones de Doble Sustitución:
Sustitución simple
Es aquella donde un átomo o grupo en un compuesto químico es sustituido por otro átomo o grupo.
Cuando una reacción implica un elemento que desplaza a otro en un compuesto, se llama reacción de sustitución simple .
Sustitución del hidrógeno de un ácido por un metal:
Ni (s) + 2 HCl (aq) -> NiCl2 (aq) + H2 (g)
Intercambio de elementos entre los reactivos que reaccionan:
3 HCl (aq) + Al(OH)3 (s) -> AlCl3 (aq) + 3 H2 O (l)
solución de nitrato de plata desplazará átomos de plata, produciendo nitrato de cobre y precipitación de cristales del metal plata.
Ejemplos de Reacciones de Sustitución simple:
Descomposición
Son aquellas en las que un compuesto concreto se descompone y divide en dos o más sustancias. Es lo que ocurre por ejemplo cuando se produce la electrólisis del agua, separándose el agua en hidrógeno y oxígeno.
Electrólisis:
2 NaCl → 2 Na + Cl
2 H2O → 2 H2 + O2
Otros tipos: 2 KClO3 → 2 KCl + 3 O2
2 HgO → 2 Hg + O2
Aislamiento y pureza del producto Calidad de los reactivos, reactivos y catalizadores
Ejemplos de Reacciones de Descomposición:
Combinación
En este tipo de reacciones químicas se combinan dos o más sustancias para formar un único compuesto. La combinación de metal y oxígeno para formar óxidos es un ejemplo, dado que da pie a moléculas relativamente estables
Combinación de óxidos con agua para formar hidróxidos:
Na2O + H2O → 2Na(OH)
CaO + H2O → Ca(OH)2
Combinación de óxidos con agua para formar oxácidos:
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
Obtención de medicinas
Preparación de detergentes
Obtención del acero
Síntesis de cosméticos
Obtención de plásticos y adhesivos
Aplicaciones
Ejemplos de Reacciones de Combinación