Actividad inicial
Características de los compuestos orgánicos
Punto 6
Tipos de mecanismos de reacción y rupturas químicas de los compuestos orgánicos.
Rupturas químicas de los compuestos orgánicos
Ruptura heterolítica
Se producen cuando uno de los grupos en que se divide la molécula se queda con los dos electrones, esto provoca que la ruptura del enlace sea asimétrica.
Ruptura Homolítica
-Reacciones radicalarias
Son producidas con el rompimiento equitativamente un enlace covalente, en donde cada átomo que se separa conserva un electrón que formaban parte del enlace original.
Tipos de mecanismos de reacción
-Reacciones de aminas:
Alquilación y acilación
-Reacciones de transposición:
El reordenamiento de los átomos de una molécula hace que se origine otra con estructura distinta.
-Reacciones de sustitución:
El átomo o grupo atómico se separa de la molécula reaccionante y es sustituido o desplazado por otro que procede del reactivo atacante.
-Reacciones de Eliminación:
Consisten en la pérdida de átomos o grupo de átomos de una molécula con formación de enlaces múltiples o anillos.
-Reacciones por Adición:
Son las reacciones en las que los enlaces múltiples se transforman a enlaces sencillos.
Punto 5
Clasificación de estructuras de los compuestos orgánicos
Cíclicas
Heterocíclicas
Homocíclicas
Aromático
Insaturado
Alicíclico
Saturado
Sencillo y arborescentes
Acíclicas
Arborescentes
Saturadas e Insaturadas
Lineales
Saturadas e insaturadas
Fórmulas usadas en la química orgánica
-Fórmula molecular:
Expresa el número exacto de átomos de los elementos presentes en un compuesto.
-Fórmula semidesarrollada:
Muestra la cantidad de hidrógenos que saturan al carbono.
-Fórmula desarrollada:
Expresa cómo están unidos todos los átomos que constituyen la molécula, también representan la tetravalencia.
-Fórmula estructural o geométrica:
Sirven para construir la molécula, observar su distribución espacial y ver la geometría de los enlaces.
Punto 4
Tipos de isomería
La isomería estudia las relaciones entre las estructuras de diferentes compuestos que tienen igual fórmula molecular (llamamos isómeros).
Isomería configuracional o estereoisomería
-Isomería geométrica:
Difieren en la geometría de los grupos de un enlace doble.
-Isomería óptica:
Difieren en su distinto comportamiento frente a la luz polarizada.
Isomería constitucional o plana
-Isomería de cadena:
Poseen el mismo grupo funcional, pero las uniones entre sus carbonos son diferentes.
-Isomería de posición:
Tienen el mismo grupo funcional pero están colocados en diferente posición dentro de la cadena carbonada.
-Isomería de función:
Tienen la misma fórmula molecular pero muestran distintos grupos funcionales.
-Tautomería:
Isómeros se interconvierten continuamente, están los dos presentes en todo momento.
Tipos de hibridación
La hibridación es la combinación de orbitales atómicos (s) y (p) para formar nuevos orbitales con diferentes orientaciones.
Hibridación sp
1 orbital "s" y 1 orbital "p" se combinan para formar 2 orbitales sp con forma lineal.
Hibridación sp2
1 orbital "s" y 2 orbitales "p" se combinan para formar 3 orbitales híbridos sp2 con forma trigonal.
Hibridación sp3
1 orbital "s" y 3 orbitales "p" se combinan para formar 4 orbitales híbridos sp3 con forma tetraédrica.
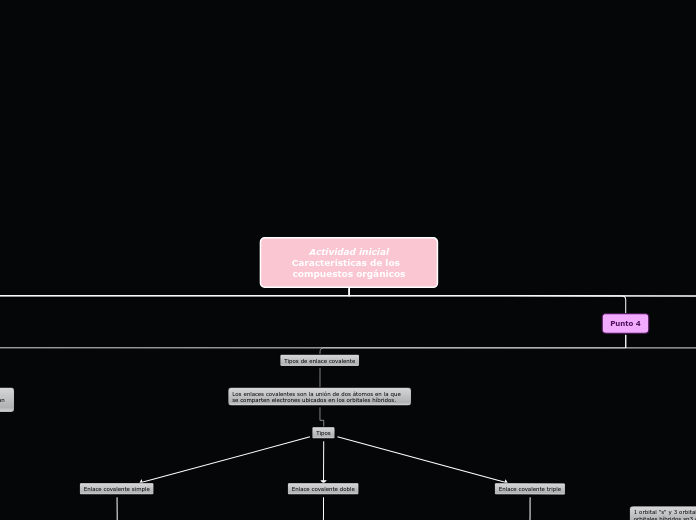
Tipos de enlace covalente
Los enlaces covalentes son la unión de dos átomos en la que se comparten electrones ubicados en los orbitales híbridos.
Tipos
Enlace covalente triple
Enlace en el que se comparten tres pares de electrones entre dos átomos.
Enlace covalente doble
Enlace en el que se comparten dos pares de electrones entre dos átomos.
Enlace covalente simple
Enlace en el que se comparte un par de electrones entre dos átomos.
Concatenación
La concatenación es la capacidad que tiene el carbono para unirse con otros carbonos y formar diversas cadenas ya sean largas o cortas.
Características de los compuestos orgánicos:
-Contienen C, casi siempre H y con frecuencia O, N, S, P.
-El enlace más frecuente es el covalente.
-Conservan las características y propiedades del carbono.
-Pocas soluciones de sus compuestos se ionizan y conducen electricidad.
-Presentan hidratación.
-La mayoría son combustibles.
-Sus estructuras pueden ser cíclicas y acíclicas
-Sus reacciones son lentas.
-Presentan isomería.
Punto 3
Formas alotrópicas
Nanotubos de carbono:
Son láminas de grafeno arrolladas que forman estructuras tubulares.
Fullerenos:
Son moléculas enlazadas de manera covalente compuestas por átomos de carbono.
Grafeno:
Es una red de átomos de carbono con dimensiones de largo y ancho.
Grafito:
Carbonos con forma de hexágonos que están unidos por tres enlaces covalentes.
Diamante:
Red de carbonos que forman tetraedros y están unidos mediante enlaces covalentes que constituyen una red covalente.
Propiedades periódicas del carbono
-Símbolo químico= C
-Óxido=ácido débil -Masa atómica=12.0107
-Numero atómico=6 -Electrones por capa= 2,4
-Periodo=2
-Bloque=p
-Estado=sólido
-Estructura cristalina=hexagonal
-Electronegatividad=2,55
-Radio covalente= 77pm -Calor especifico=710 J/(K-Kg)
Punto 2
Diferencias entre los compuestos orgánicos y los compuestos inorgánicos.
Compuestos inorgánicos
-Sus enlaces son iónicos.
-Su volatilidad es baja. -Su combustibilidad es baja.
-Su punto de ebullición y fusión son bajos.
-Son solubles en agua.
-No son sintetizados por los seres vivos.
-Son buenos conductores de electricidad.
Compuestos orgánicos
-Son enlaces covalentes de carbono-carbono o carbono-hidrógeno.
-Su volatilidad es alta. -Su combustibilidad es alta.
-Tiene punto de ebullición bajo. -Su punto de fusión es bajo.
-Tienen alta volatilidad.
-Tienen la capacidad de formar cadenas.
Punto 1
Historia
Los padres de la química orgánica son Friedrich Wöhler y Archibald Scott.
El término de química orgánica surgió a finales del siglo XVlll gracias a la "teoría vitalista" planteada por Berzelius.
-En 1776 Lavoisier descubrió que los productos provienen de los animales y vegetales están compuestos por Carbono e Hidrogeno.
-En 1807 Berzelius nombró a los compuestos orgánicos.
-En 1828 Wöhler demostró que la materia orgánica se podía crear de manera química.
-En 1845 Hoffmann demostró la estructura de la anilina.
-En 1858 Kekulé y Couper propusieron una nueva teoría estructural y la tetravalencia del carbono.
Concepto de la química orgánica
Es la rama de la química que estudia a todos los compuestos de carbono y sus reacciones.