каких?
одноклеточные водоросли
цианобактерии
их долгое время называли «сине-зелеными водорослями»
грибы
бактерии
Использованные публикации
Mosher e.a., 2009
Mosher R., Crawford K., Lukowiak A. A Soy-Based Alternative to Traditional Bacterial Nutrient Media. American Biol. Teacher. 2009; 71(1): 49-51. doi:10.1662/005.071.0111
Basu e.a., 2012
Basu S, Bose C, Ojha N, Das N, Das J, Pal M, Khurana S. Evolution of bacterial and fungal growth media. Bioinformation. 2015; 11(4): 182-184. doi: 10.6026/97320630011182
Arulanantham e.a., 2012
Arulanantham R., Pathmanathan S., Ravimannan N., Niranjan K. Alternative culture media for bacterial growth using different formulation of protein sources. J. Nat. Prod. Plant Resour. 2012; 2(6): 697-700.
Лабораторная работа 4/1
оформление результатов
Выполняется внеаудиторно. Загружается дистанционно для оценки преподавателем с использованием выбранного формата интерактивного общения (LMS, облачное файлохранилище, социальные сети, онлайн-сервисы организации совместной работы и т.д.).
дополнительный отчет - количественный
Дополнительный отчет по всей работе целиком готовится после занятия 5, на котором студенты учитывают результаты роста микроорганизмов. В рамках работы 5/1 подсчитывается количество колоний на чашках Петри (для работы 4/1 учитываются только результаты визуального подсчета). Необходимо сравнить количество колоний, выросших на контрольных и опытных средах.
Учет роста в жидких средах проводится количественно турбидиметрическим методом по оптической плотности суспензий клеток при длине волны 595-610 нм (на кюветном или планшетном фотометре) или полуколичественно путем сравнения мутности суспензий со стандартами мутности МакФарланда
все протоколы - описательное
В свободной форме, содержащей:
- рабочие протоколы выполнения работы,
- фотографии поэтапного выполнения протоколов.
лабораторные протоколы
4/1 е. Приготовление агара на основе селитряного удобрения
Протокол выполнения опыта
В экспериментах как тестовые указаны грибы Penicillium roqueforti и Botrytis cinerea. По усмотрению преподавателя они могут быть заменены на любые другие грибы, не являющиеся патогенными для человека, и способными расти на контрольной и опытных средах.
Приготовление среды
- для приготовления 100 мл среды возьмите половину чайной ложки сахара и растворите его в 80 мл теплой воды;
- отмерьте 1 чайную ложку жидкого комплексного удобрения «Калийная селитра» с микро- и макроэлементами с содержанием азота 6-8% и добавьте к смеси, хорошо перемешайте;
- добавьте 1,2 г агар-агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агар-агара;
- закройте колбу плотно ватно-марлевой пробкой;
- передайте колбу лаборанту для стерилизации в автоклаве.
Заливка чашек Петри автоклавированной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
Нанесение образцов на чашки для культивирования
- по поверхности одной чашки Петри распределите 0,1 мл суспензии клеток Penicillium roqueforti, предоставленную преподавателем;
- по поверхности другой чашки Петри распределите 0,1 мл суспензии клеток Botrytis cinerea, предоставленную преподавателем;
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
4/1 д. Приготовление агара Чапека (контрольная для грибов)
Протокол выполнения опыта
В экспериментах как тестовые указаны грибы Penicillium roqueforti и Botrytis cinerea. По усмотрению преподавателя они могут быть заменены на любые другие грибы, не являющиеся патогенными для человека, и способными расти на контрольной и опытных средах.
Приготовление среды
- для приготовления 100 мл среды взвесьте 3 г сахарозы, 0,2 г натрия нитрата, 0,1 г калия гидрофосфата, 0,05 г магния сульфата, 0,05 г калия хлорида и 10 мг железа(II) сульфата;
- растворите все в 80 мл теплой воды;
- добавьте 1,5 г агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агара;
- закройте колбу плотно ватно-марлевой пробкой;
- передайте колбу лаборанту для стерилизации в автоклаве.
Заливка чашек Петри автоклавированной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
Нанесение образцов на чашки для культивирования
- по поверхности одной чашки Петри распределите 0,1 мл суспензии клеток Penicillium roqueforti, предоставленную преподавателем;
- по поверхности другой чашки Петри распределите 0,1 мл суспензии клеток Botrytis cinerea, предоставленную преподавателем;
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
4/1 г. Приготовление картофельно-глюкозного бульона (опытная для дрожжей)
Протокол выполнения опыта
В экспериментах как тестовые указаны дрожжевые грибы Saccharomices cerevisiae и Schizosaccharomyces pombe. По усмотрению преподавателя они могут быть заменены на любые другие дрожжевые грибы, не являющиеся патогенными для человека, и способными расти на контрольной и опытных средах.
Приготовление среды
- для приготовления 100 мл среды нарежьте 20 г неочищенного картофеля тонкими ломтиками;
- прокипятите 30 мин в 100 мл воды;
- профильтруйте отвар (ломтики картофеля отбросьте);
- отвар охладите, добавьте 2 г глюкозы;
- доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу, закройте её плотно ватно-марлевой пробкой;
- передайте колбу лаборанту для стерилизации в автоклаве.
Заливка автоклавированной среды в пробирки
- стерилизованную среду охладить до температуры примерно 30°С и добавить в неё по 1 мл стерильных растворов хлортетрациклина или тетрациклина (4 мг/мл) и хлорамфеникола (левомицетина) (2,5 мг/мл);
- разлить в большие культуральные пробирке по 15-20 мл (в зависимости от размера пробирки) в стерильных условиях (например, в ламинарном шкафу);
- пробирки можно сразу использовать для инокуляции микроорганизмами.
Нанесение образцов на чашки для культивирования
- в одну пробирку внесите 1 мл суспензии клеток Saccharomices cerevisiae, предоставленную преподавателем;
- в другую пробирку внесите 1 мл суспензии клеток Schizosaccharomyces pombe, предоставленную преподавателем;
- поставьте необходимые пометки на пробирках и закройте их;
- передайте пробирки лаборанту для инкубации до занятия 5.
4/1 в. Приготовление жидкой среды YPD (контрольная для дрожжей)
Протокол выполнения опыта
В экспериментах как тестовые указаны дрожжевые грибы Saccharomices cerevisiae и Schizosaccharomyces pombe. По усмотрению преподавателя они могут быть заменены на любые другие дрожжевые грибы, не являющиеся патогенными для человека, и способными расти на контрольной и опытных средах.
Приготовление среды
- для приготовления 100 мл среды взвесьте 0,3 г дрожжевого экстракта, 1 г пептона и 1 г глюкозы;
- растворите всё в 80 мл теплой воды;
- доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу, закройте её плотно ватно-марлевой пробкой;
- передайте колбу лаборанту для стерилизации в автоклаве.
Заливка автоклавированной среды в пробирки
- стерилизованную среду охладить до температуры примерно 30°С и добавить в неё по 1 мл стерильных растворов хлортетрациклина или тетрациклина (4 мг/мл) и хлорамфеникола (левомицетина) (2,5 мг/мл);
- разлить в большие культуральные пробирке по 15-20 мл (в зависимости от размера пробирки) в стерильных условиях (например, в ламинарном шкафу);
- пробирки можно сразу использовать для инокуляции микроорганизмами.
Нанесение образцов на чашки для культивирования
- в одну пробирку внесите 1 мл суспензии клеток Saccharomices cerevisiae, предоставленную преподавателем;
- в другую пробирку внесите 1 мл суспензии клеток Schizosaccharomyces pombe, предоставленную преподавателем;
- поставьте необходимые пометки на пробирках и закройте их;
- передайте пробирки лаборанту для инкубации до занятия 5.
4/1 б. Приготовление твердой среды из сухого пищевого бульона (опытная для бактерий)
Протокол выполнения опыта
В экспериментах как тестовые указаны бактерии Escherichia coli и Bacillus subtilis. По усмотрению преподавателя они могут быть заменены на любые другие бактерии, не являющиеся патогенными для человека, и способными расти на контрольной и опытных средах.
Приготовление среды
- для приготовления 100 мл среды возьмите 2 чайных ложки сахара и 1 чайную ложку куриного или говяжего сухого бульона;
- хорошо размешайте всё в 80 мл теплой воды;
- добавьте 1,2 г агар-агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агар-агара;
- закройте колбу плотно ватно-марлевой пробкой;
- передайте колбу лаборанту для стерилизации в автоклаве.
Заливка чашек Петри автоклавированной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
Нанесение образцов на чашки для культивирования
- по поверхности одной чашки Петри распределите 0,1 мл суспензии клеток Escherichia coli, предоставленную преподавателем;
- по поверхности другой чашки Петри распределите 0,1 мл суспензии клеток Bacillus subtilis, предоставленную преподавателем;
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
4/1 а. Приготовление LB-агара (контрольная для бактерий)
Протокол выполнения опыта
В экспериментах как тестовые указаны бактерии Escherichia coli и Bacillus subtilis. По усмотрению преподавателя они могут быть заменены на любые другие бактерии, не являющиеся патогенными для человека, и способными расти на контрольной и опытных средах.
Приготовление среды
- для приготовления 100 мл среды взвесьте 1 г ферментативного гидролизата казеина (или триптона, или пептона), 0,5 г дрожжевого экстракта и 1 г NaCl;
- растворите NaCl в 80 мл теплой воды;
- в полученном солевом растворе растворите остальные компоненты среды;
- добавьте 1,5 г агара, суспендируйте и доведите объем смеси до 100 мл водой в мерном цилиндре;
- перенесите смесь в колбу и перемешивайте при нагревании на водяной бане до полного растворения агара;
- закройте колбу плотно ватно-марлевой пробкой;
- передайте колбу лаборанту для стерилизации в автоклаве.
Заливка чашек Петри автоклавированной средой
- стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);
- после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
Нанесение образцов на чашки для культивирования
- по поверхности одной чашки Петри распределите 0,1 мл суспензии клеток Escherichia coli, предоставленную преподавателем;
- по поверхности другой чашки Петри распределите 0,1 мл суспензии клеток Bacillus subtilis, предоставленную преподавателем;
- поставьте необходимые пометки на крышках чашек Петри и закройте их;
- передайте чашки Петри, лаборанту для инкубации до занятия 5.
организация работы
В работе используются три контрольных среды (обычно используемые в лабораториях) и три опытных среды (из легко доступных компонентов).
Подготовительная часть (преподаватель + лаборант): подготовка необходимых материалов и оборудования.
Основная часть 1 (студенты в начале занятия): студенты делятся на подгруппы по числу приготавливаемых питательных сред (контрольных и опытных).
Основная часть (лаборант, в течение занятия): стерилизация сред, приготовленных студентами.
Основная часть 2 (студенты в конце занятия): студенты разливают свои твердые среды после стерилизации по стерильным чашкам Петри (2 чашки с каждой средой), а жидкие - по стерильным пробиркам (2 с каждой средой); после остывания сред - засевают чашки и пробирки микроорганизмами.
Последующая часть (лаборант): инкубация чашек Петри и пробирок с питательными средами, инокулированных образцами, в термостате (25°С для грибов и 37°С для дрожжей и бактерий) с проверкой роста 2 раза в день. При достижении целевого уровня роста (числа и размера колоний или мутности; критерии определяются преподавателем с учетом возможностей лаборатории) чашки переносятся из термостата в холодильник (+4°С) и сохраняются там до дня занятия 5. За 1 час до начала занятия чашки переносятся из холодильника в термостат с соответствующей температурой.
Важно! Поскольку студенты работают с разными условиями экспериментов преподавателю следует обеспечить студентам возможность ознакомиться с результатами друг друга. Делать это в ходе выполнения эксперимента или во время заключительного мини-коллоквиума занятия - выбор преподавателя.
результаты обучения
вопросы для обсуждения
- Какие питательные среды называют минимальными и почему?
- Как выбирать источники углерода и азота, подходящие для выращивания определенным микроорганизмов?
- Как можно только за счет подбора состава среды стимулировать рост одних микроорганизмов и подавить рост других?
развиваемые навыки
- готовить питательные среды по готовым прописям
- стерилизовать питательные среды
- работать в асептических условиях
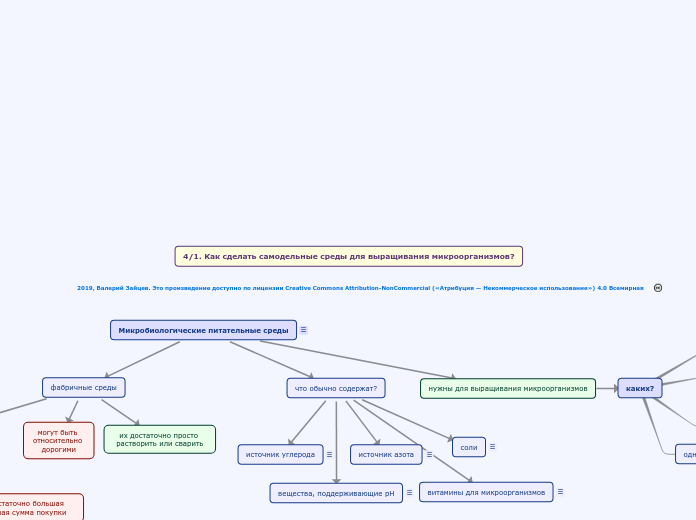
Микробиологические питательные среды
Одна из наиболее широко применяемых в отечественных исследованиях сред для выращивания инфузорий рода Paramecium - среда Лозино-Лозинского.
Обычно она готовится в виде концентрата 10-кратной концентрации (10x). Концентрат среды Лозина-Лозинского готовится следующим образом: в 1 литре дистиллированной воды растворяют 0,1 г NaCl, 0,01 г KCl, 0,2 г NaHCO3, 0,01 г MgSO4 х 7 H2O, 0,01 г CaCl2. Для приготовления рабочего раствора (инкубационной смеси) смешивают 1 объем концентрата с 9 объемами воды (например, 100 мл концентрата + 900 мл воды).
Культура парамеций лучше всего выращивать при температуре 20-25˚C с естественной рассеянной освещенностью в течении дня или с искусственным чередованием света и темноты («день-ночь») 12 + 12 часов в течение суток.
В качестве корма можно использовать множество веществ и продуктов, но одним из самых простых, доступных и легко стандартизируемых вариантов являются обычные сухие пекарские дрожжи. Активные (быстрорастворимые) дрожжи лучше, чем те, которые требуют предварительной инкубации в жидкости. Рекомендуемый режим кормления 0,07 г сухих дрожжей на культуру объемом 400-600 мл 2 раза в неделю. Перед добавлением в культуру дрожжи суспендируются в 10 мл воды для более равномерного распределения в культуре.
Через каждые 1-2 недели культуру инфузорий требуется отмывать от остатков корма и продуктов метаболизма. Для этого культуру инфузорий переливают в узкогорлую колбу, которую накрывают темной тканью, оставляя открытым горлышко. Средой Лозино-Лозинского доводят до верха. Через некоторое время инфузории выплывают в верхнюю часть колбы, после чего их отбирают дозатором на 10 мл и переносят в чистый стакан, а затем снова доливают средой Лозино-Лозинского. Процедура повторяется до тех пор, пока культура не станет прозрачной. После отмывки инфузории необходимо покормить, а на сосуд с ними поставить дату последней отмывки.
что обычно содержат?
вещества, поддерживающие pH
Создают среду с нужной величиной рН и определенной буферной емкостью, чтобы в ходе выращивания не происходило закисления или защелачивания питательной среды
витамины для микроорганизмов
Соединения которые необходимы микроорганизмам, но ими сами не синтезируются, например, п-аминобензойная кислота
соли
Обычно используются для создания нужного осмотического давления и ионной силы, а также как источники микроэлементов
источник азота
Чаще всего - аминокислоты, амины, пептиды, могут быть белки, нуклеотиды
источник углерода
Чаще всего - какие-нибудь углеводы (сахара), например, глюкоза, сахароза, целлюлоза, крахмал
нужны для выращивания микроорганизмов
фабричные среды
их достаточно просто растворить или сварить
могут быть относительно дорогими
можно купить только в соответствующих фирмах
часто - достаточно большая минимальная сумма покупки
Фирмы, продающие среды, часто не работают с физическими лицами
2019, Валерий Зайцев. Это произведение доступно по лицензии Creative Commons Attribution-NonCommercial («Атрибуция — Некоммерческое использование») 4.0 Всемирная
4/1. Как сделать самодельные среды для выращивания микроорганизмов?