によって betsabe jimenez 5年前.
274
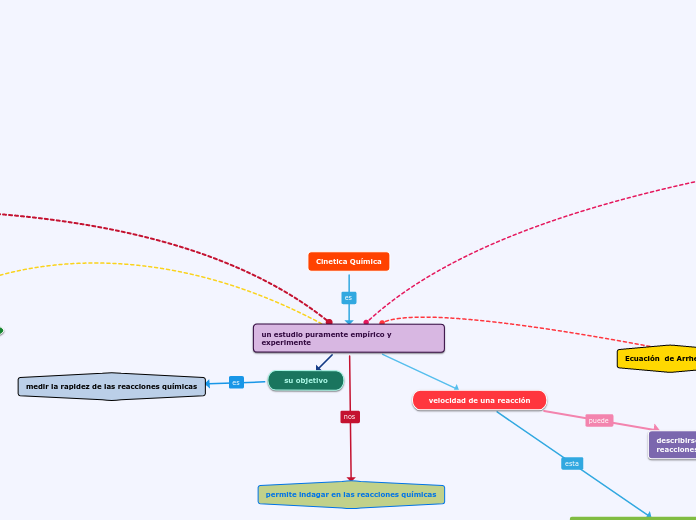
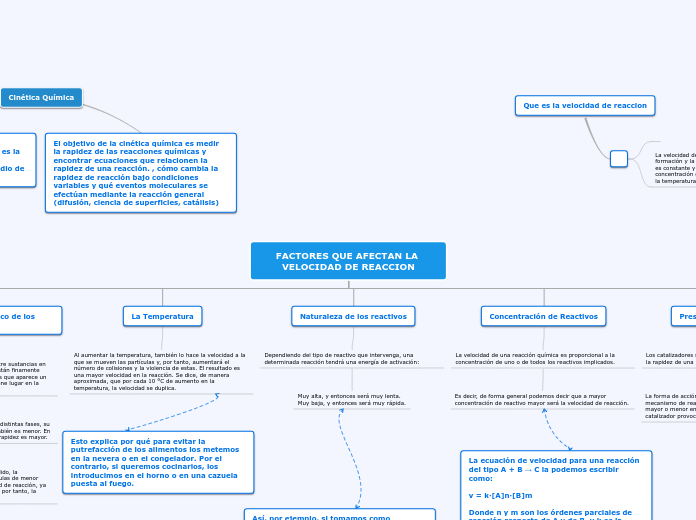
Cinetica Química
En el ámbito de la química, la teoría del estado de transición y la cinética química son fundamentales para comprender cómo se desarrollan y miden las reacciones químicas. La teoría del estado de transición, desarrollada en 1935 por Henry Eyring, se centra en calcular las constantes de velocidad basándose en las superficies de energía potencial.