Metales de Transición
Cobre (Cu)
Circuitos impresos y componentes electrónicos
CuSO4 para fungicidas y pesticidas
NH3 reemplaza H20
Azul oscuro
[Cu(H2O)6]
azul
Oxosales
CuSO4.5H20
deshidratado = blanco
Color azul
En exceso de X forman complejos
CuBr2
casi negro
CuCl2
CuF2
incoloro
Hidróxido
Cu(OH)2
[Cun(OH)n+2] 2-
azul oscuro
Caracter anfótero
CuO
CuO + CO --> Cu + CO2
CuO + H2 --> Cu + H2O
CuNo3 --> CuO + NO2
+1
El exceso es en extremo venenoso, se utilizan agentes quelantes para tratarlo
Hemocianinas, moleculas trasportadoras de oxígeno entre los invertebrados
Es un oligoelemento biológicamente importante luego del hierro.
Calulas solares sensibilizadas
Catalizadores
Pigmentos azules y verdes
muy insolubles en agua
2 Cu 2+ + 4I- --> 2CuI2 --> 2CuI + I2
Precipita rápido
Cu 2+ + 2X- + Cu0 --> 2CuX
CuBr amarillo pálido
CuCl blanco
No se conoce el fluoruro
Sulfuros
Cu2S
2Cu + S0 --> Cu2S
Sólido cristalino negro
Cu2O
2CuO --> Cu2O + 1/2O2
Cristales rojos
Complejos lineales
Son diamagnéticos e incoloros
Estabilidad: depende del equilibrio
Cu0 + Cu2+ --> 2Cu+ E0= -0.37V
Níquel (Ni)
+2
Compite con el Cu por algunos situos de coordinación
Es retenido por el riñon por un sistema proteico
Baterías
Imanes
Industria aeroespacial
Cuadrados planos
[Ni(DMG)2]
rojo
[Ni(CN)4]2-
amarillo
Son diamagnéticos
Tetrédricos
Color azul intenso
[NiX4]2-, [NiX2L2], [Ni(L-L)2]2+
[Ni(H2O)6]2+
Muchos L desplazan al agua
Son paramagnéticos
color verde, muy lábil
Cianuro: [Ni(CN)2 precipitado amarillo
Los cuatro halogenuros son anhidridos o hexanhidridos NiX2.NiX2.6H2O
menos el F- = NiF2.3H2O
Hidróxido Ni(OH)2
Gel de color verde
No muestra anfoterismo, soluble en ácidos
Precipita en soluciones acuosas de sales de Ni II por adición de metales alcalinos
Óxidos NiO
Sólido de color verde
Se obtiene al calentar el hidróxido
Se disuelve en ácidos
Carácter básico
Cobalto (Co)
Es utilizada por bacterias para producir metano
Elemento indispensable, contenido en la vit B12, su carencia provoca anemia perniciosa
Pigmentos y tintes
Radioterapia
Aleaciones de cobalto
Oxidación:
[CoL6]2+ + O2 --> [CoL6]3+
[Co(H2O)6]2+ + 6L --> [CoL6]2+ + 6H2O
Y combinación de dos ligandos X y dos neutros [CoL2X2]
ligandos aniónicos monodentados: Cl-, Br-, I-, SNC-, OH-
Octaédricos
[Co(EDTA)]2-
[Co(dipy)3]2+
[Co(en)3]2+
[Co(NH3O]6]2+
[Co(H2O)6]2+
[Co(NH3O)6]2+ --> [Co(NH3O)6]3+ +1e E0ox= -0.1V
Presencia de ligandos fuertes
[Co(H2O]62+ --> [Co(H2O)]63+ + 1e E0ox= -1.84V
Soluciones sin agentes complejantes
Complejo más estable
CoCl2 + HF --> CoF2
Por deshidratación de los halógenos hidratados
Óxidos
CoO
Al calentarlo se obtiene Co3O4
Verde claro
Hierro (Fe)
Ferritina, almacen de hierro
Industria química
Tratamiento de aguas
Fabricación de acero
No existen aminocomplejos en solución
Tetraédricos
[FeCl4]-
La mayoría octaédricos
Sales rosadas claras o blancas
Por eso no existe FeS3
Sales solubles con aniones que no reduzcan el Fe(III) a Fe(II)
No estable
3I- + Fe3+ --> 3/2I2 + Fe2+
Estables
FeF3, FeCl3, FeBr3
Tendencia a la hidrólisis
...................... --> [Fe(OH)6]3- + H+
[Fe(H2O)5(OH)]2+ --> [Fe(H2O)4(OH)2]+ + H+
[Fe(H2O)6]3+ --> [Fe(H2O)5(OH)]2+ + H+
Poder polarizante de Fe3+
Cadena respiratoria, citocromos
Constituyente principal de la hemoglobina, deficiencia de Fe 2+ causa anemia
fertilizantes y aditivos para el suelo
Pigmentos para pintura y tintas
Suplementos nutricionales
Los complejos tetraédricos son pocos y más coloreados.
[Fe(fen)3]3+ + e- --> [Fe(fen)3]2+ E0=1.12V
[Fe(H2O)6]3+ + e- --> [Fe(H2O)6]2+ E0=0.77V
[Fe(CN)6]3- + e- --> [Fe(CN)6]4- E0=0.36V
La mayoría octaédricos, pueden oxidarse a férrico
Sales
Tienden a oxidarse
Solubles con excepción de carbonatos y sulfuros
Forma sales estables con todos los aniones estables
Existen los cuatro en forma anhidrida
FeI2.4H2O verde pálido
FeBr2.6H2O verde pálido
FeCl2.6H2O verde pálido
FeF2.8H2O incoloro
2Fe(OH)2 + HO --> Fe2O3.nH2O E0=0.56V
2Fe2+ + 1/2O2 + 2H- --> 2Fe3+ + H2O E0=0.46V
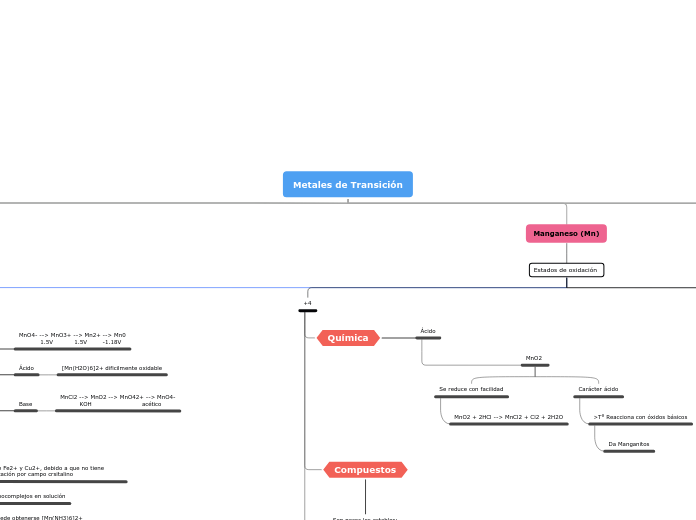
Manganeso (Mn)
Estados de oxidación
+7
KMnO4: Oxidante, Reactivo analítico
Reducción
MnO4- + 8H+ + 5e --> Mn2+ + 4H2O E0= 1.51V
MnO4- + 2H2O + 3e --> MnO2 + 4OH- E0= 1.23V
4MnO4- + 4H- --> 4MnO2 + 2H2O + 3O2
Catalizada por la luz
Obtención:
A partir de MnO4- en medio sulfúrico
MnO4-
3MnO42- + 4H+ --> 2MnO4 + MnO2 + 2H2O
verde violeta marrón
Carácter no metálico
Obtención:
MnO2 + 2K2O + O2 --> 2K2MnO4
+4
Catalizador
MnO2: Fabricación de pilas secas
Son pocos los estables:
Mn(SO4)2
MnCl4
MnO2
MnO2
Carácter ácido
>T° Reacciona con óxidos básicos
Da Manganitos
Se reduce con facilidad
MnO2 + 2HCl --> MnCl2 + Cl2 + 2H2O
+2
Importante constituyente del sistema nervioso central
Agente redoz
Enzima hepática arginasa
conviertes desechos nitrogenados en urea
Crucial en enzimas vegetales ya animales
Aceros especiales
Aleaciones ferromanganeso (Fe-Mn-C)
IC:6 Rosado tenues
IC: 4 Amarillo-verdoso
Con NH3 líquido puede obtenerse [Mn(NH3)6]2+
No existen los aminocomplejos en solución
Menos estables que Fe2+ y Cu2+, debido a que no tiene energía de estabilización por campo crsitalino
Química
MnCl2 --> MnO2 --> MnO42+ --> MnO4-
KOH acético
[Mn(H2O)6]2+ dificilmente oxidable
MnO4- --> MnO3+ --> Mn2+ --> Mn0
1.5V 1.5V -1.18V
Cromo (Cr)
+6
Estado de oxidación más estable
Alcoholimetro
Se utilizan para pintar las marcas amarillas en la calle
K2Cr2O7 + H2SO4 (mezcla sulfocrómica) desengrasante para limpiar material de vidrio
Dicromato y cromato como agentes oxidantes
((NH4)Cr2O7 --> Cr2O3 + N2 +4H2O
Sales de cromilo
CrO3 + 2HCl --> CrO2Cl2 + H2O
K2CrO4 + NaCl + 3H2SO4 --> 2CrO2Cl2 + K2SO4 + 2Na2SO4 + 3H2O
CrO3 en solución es ácido
CrO3 + H2O --> H2CrO4
Cr2O72- + H2O
Naranja
Cr2O72- + 14H+ + 6e --> 2Cr3+ + 7H20
2CrO4 2- + 2H+ -->
Amarillo
CrO4 + 4H2O + 3e --> (Cr(OH)3 5OH-
Presenta carácter no metal
Oxidante enérgico
Enlaces covalentes (no existe el +6)
+3
Proporciona un recubrimiento brillante y protector a las superficies de hierro y acero
Se emplea en la fabricación de aleaciones metálicas para usos especializados
Interviene en la regulación de glucosa en la sanfre, por lo cual una deficiencia podría causar diabetes.
Aplicaciones:
Aleaciones anticorrosivas
Depósitico electrolític para evitar corrosión (cromados)
Acero inoxidables
[Cr(OH)6]3-
[CrX6]3-
X= F-, Cl-. Br-, SCN-, CN-
Cr2O3 anfóterio
(NH4)2Cr2O7 --> N2 + Cr2O3 + 4H2O
OH
[Cr(H2Ov(OH)n]x (cromitos)
H+
[Cr(H2O)6]3+
CrF3, CrCL3, CrBr3 y formas hidratadas
halogenuros acuocomplejos
CrCl3 + 6H20 --> [Cr(H2O]Cl3
El más estable y con mayor carácter metálico
Las sales presipitan Cr(OH)3
Vanadio (V)
Estados de Oxidación
+5
El V2O5 se utiliza como catalizador, sobre todo en la obtención de ácido sulfúrico
pH 10
V2O74- + 2OH- --> 2VO43- + H2O
2VO3- + 2OH- --> V2O74- + H2O
pH<6.8
pH <<
V10O286-
HV10O285-
H2V10O284-
Vanadatos
V2O5 + ác fuerte
VO2+
V2O5 + NaOH
VO43-
Oxido de vanadio (V)
NH4VO3 + H2SO4 --> V2O5
Halogenurus
VF5
V2O5 + 6NaOH --> 2Na3VO4 + 3H2O
V2O5 + H2SO4 --> (VO2)2SO4 + H2O
Estado de oxidación más estable.
Son aleaciones muy duras que se usan en hojas de cuchillos y en herramientas para taller.
Amanita muscaria
Es un hongo venenoso que también utiliza vanadio pero no se ha comprendido bien el porqué.
Es vital para los tunicados o monos marinos
Utilizan niveles muy altos de vanadio en su plasma sanguíneo para transportar oxígeno
Aplicaciones
Aceros al vanadio
Como metal, en aleaciones con hierro, llamada ferrovanadio
Oxigenados
VO2
Anfótero
Color azul oscuro
VO2+ H2SO4 --> VOSO4 + H2O
VO2 + 4NaOh --> Na4VO4 + 2H2O
Halogenuros
Vanadio (IV) actúa como no metal
VCl4
VCl4 + H2O --> VCl3 + HCl
2VCl3 --> VCl2 + VCl4
VCl3 --> VCl2 + 1/2Cl2
No se encuentra V+4 en solución
(alta energía de ionización)
VO2+ ion oxovanadio o vanadilo
VO2++ + H2SO3 ---> VO+2
Titanio (Ti)
Estados de oxidación
+3
Tricloruro de titanio
TiCl3
Obtención: Reducción del TiCl4 con H2
Dicloruro de titanio
TiCl2
Obtención: Síntesis a altas T°
Química en solución
Es más metálico que el +4, en medio alcalino se obtiene Ti(OH)3
Su hidróxido no es anfótero
La solución acuosa del ion [Ti(H2O)6]+3 se obtiene por reducción electrolítica o con Zn de soluciones acuosas de Ti(+4)
TiO(+2)(ac) + 2H(+) + e(-) ---> Ti(+3) + H2O
+4
Estado de oxidación más estable.
Química de la vida
El oxido de titanio IV reemplazó totalmente al plomo blanco que antes se utilizaba como pigmento en las pinturas. Este es menos toxico y posee un índice de refracción más alto que cualquier otra sustancia inorgánica blanca.
Es el preferido para emplearse en aviones militares y submaniros nucleares, debido a la alta resistencia y baja densidad que posee el elemento.
Aplicación
Elrutilo se utiliza como pigmento blanco en pinturas
Se utilizan en las instalacones químicas poruqe resiste a todos los ácidos inorgánicos
Construcci´no de trenes, automoviles, camiones y bicicletas
Construcción de piezas de motorores de propulsión a chorro y en construcción aeronáutica
Compuestos
Complejos
Peroxocomplejos
[Ti(O2)(OH)]+
Coloración naranja intenso
Aductos TiX4
Forman aductos TiX4L o TiX4L2
[TiCl4(OPCl3]2
Sólidos cristalinos solubles
en disolventes orgánicos
Oxoaniones
Titanatos
CaTiO3
perovskita
FeTiO3
ilmenita
Importancia ferroélectrica
Compuestos Binarios
Óxido
Óxido de titanio
TiO2
Haluros
Tetracloruro de titanio
TiCl4
Liquido incoloro de olor picante que
hidroliza muy fuerte en agua
TiCl4 + 2H2O --> TiO2 + 4HCl
Química en solución
Base
No existe el hidróxido de Ti(OH)4 por su carácter no metálico
TiO2 + 2NaOH --- Na2TiO3 + H2O
Las sales de Ti (IV) en medio alcalino parecen precipitar TiO2 hidratado
Ácido
En solución siempre existe el ion titanilo y no el Ti(+4)
TiO2 + H2SO4 ---> TiO+2 (Ion titanilo)
El ion titanilo se reconoce con agua oxigenada, da un compuesto de color naranja.