Primera Ley de Termodinámica
Sistema Cerrado
Ecuaciones Termodinámicas
Politrópico
Reversible
CvlnT2/T1+RlnV1/V2
mu+W
1/1-n(P2V2-P1V1)
P1/P2=(V2/V1)^n
PV^N=c
Adiabático
Reversible
Cambio S
Cambio U
1/1-K(P2V2-P1V1)
Relación p-V-T
P1/P2=(V2/V1)^K
PV^k=c
Isotérmico
Reversible
RlnV2/V1
P1V1lnV2/V1
P1/P2=V2/V1
T=cte
Isométrico
Reversible
Cv lnT2/T1
Cp(T2-T1)
m(u2-u1)
0
P1/P2=T1/T2
V=cte
Isobárico
Reversible
Cambio s
Cp lnT2/T1
Cambio u
Cv(T2-T1)
Cambio h
Cp(T1-T2)
Q
m(h2-h1)
W
P(V2-V1)
Relación
p-V-T
V1/V2=T1/T2
Relación p-V
P=cte
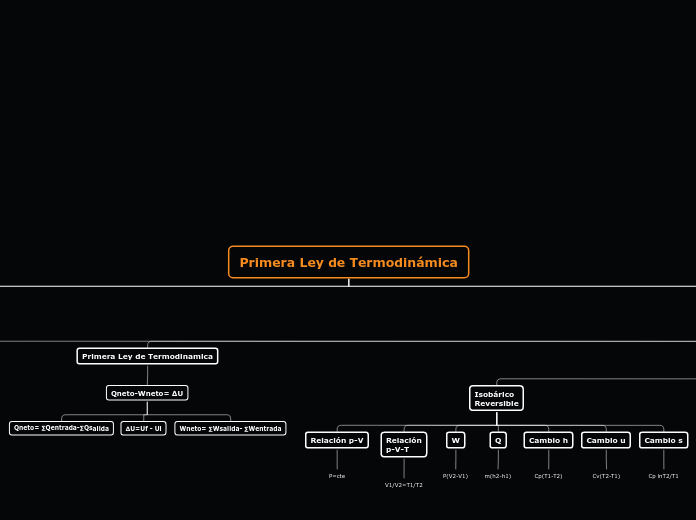
Qneto-Wneto= ∆U
∆U=Uf - Ui
Procesos
Adiabatico
Un proceso adiabático es aquel en el cual el sistema termodinámico no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isoentrópico.
Isometrico
El proceso isocórico es el proceso de compresión por el cual el volumen de un gas permanece constante pero la presión y la temperatura de un gas varían.
Isotermico
La temperatura permanece constante en todo momento, o la menos durante su estudio
Es un proceso de compresión donde los factores que varían son la presión y el volumen
Formulas
Irreversible
Isobarico
Es un cambio en el estado de una cierta cantidad de materia en la que la presión permanece constante. Lo que sí cambia es una o más de sus variables de estado. Si se transfiere calor al sistema se realiza trabajo y también cambia la energía interna del sistema.
Fromulas
Irreversibe
Reversible
Subtopic
Sistema Abierto
Dispositivos
- Cámara de mezcla
*Características*
Q ≈0. El proceso es adiabático, ya que siempre están bien aisladas.
W =0. No implica trabajo.
ΔEc≈0. El cambio de energía cinética , si es que ocurre, es insignificante.
ΔEp≈0. No hay cambio en la energía potencial o suele ser despreciable.
- Válvulas de estrangulamiento
*Características*
Q =0. El proceso es adiabático, ya que no hay ni tiempo suficiente ni área lo bastante grande para que ocurra alguna transferencia de calor efectiva.
W =0. No se efectúa trabajo.
ΔEp=0. El cambio de energía potencial, si es que ocurre, es insignificante.
ΔEc=0. Aun cuando la velocidad de salida es a menudo considerablemente más alta que la velocidad de salida, en muchos casos, este aumento es insignificante.
- Intercambios de calor
*Características*
W =0. No implica trabajo.
ΔEc≈0. El cambio de energía cinética, si es que ocurre, es insignificante.
ΔEp≈0. El cambio de la energía potencial es despreciable.
Turbinas y compresores
*Características* Q neto≈0. La relación de transferencia de calor para estos dispositivos es pequeña respecto al trabajo del eje, a menos de que haya un enfriamiento deliberado.
W neto≠0. Todos estos dispositivos implican ejes rotatorios que cruzan sus fronteras, por lo que el término trabajo es importante.
ΔEp≈0. El cambio de energía potencial que experimenta un fluido cuando fluye por turbinas, ventiladores, compresores y bombas suele ser muy pequeño y casi siempre se omite.
ΔEc≈0. Las velocidades involucradas en estos dispositivos, con excepción de las turbinas, suelen ser demasiado bajas para producir algún cambio significativo en la energía cinética.
- Toberas y Difusores
*Características*
Q neto≈0. La relación de transferencia de calor suele ser muy pequeña aunque no estén bien aislados.
W neto≈0. Estos dispositivos no realizan trabajo.
ΔEp≠0. Hay una variación en la energía cinética, significativa, en estos dispositivos.
ΔEp≈0. Comúnmente los fluidos experimentan poco o ningún cambio en su elevación.
Primera Ley de Termodinamica
Qneto-Wneto= ∆H+∆Ec+∆Ep
Wneto= ∑Wsalida- ∑Wentrada
∆H=m(h2-h1)
∆Ec=1/2m(vsal^2-vent^2)
∆Ep=mg(z2-z1)
Qneto= ∑Qentrada-∑Qsalida