によって Mariana Feria 3年前.
433
QUÍMICA GENERAL 2020-1
El estudio de la química general incluye el análisis detallado de diversas mediciones y la aplicación de cifras significativas para asegurar precisión y exactitud en los resultados.
によって Mariana Feria 3年前.
433

もっと見る
comparación
la elección de una unidad de concentración depende al propósito del experimento
molalidad
numero de moles de un soluto disueltos en 1kg de un disolvente
molalidad=moles de soluto/ masa de disolvente(kg)
molaridad
numero de moles en un soluto
molaridad=moles de soluto/litros de disolución
fracción molar
la fracción molar de un componente de una disolución
facción molar=Xa=moles de a/suma de moles de solución
porcentaje en masa
es la relación de la masa de un soluto en la masa de una disolución
%masa=(masa de soluto/masa de disolucion)X100%
electronegatividad
capacidad de un átomo para atraer hacia así, los electrones de un enlace químico
n° oxidacion
es el numero entero que representa el numero de electrones que un átomo pone en juego cuando forma un compuesto
ley del octeto
propuesta por lewis, un átomo diferente del hidrógeno tiende a formar enlaces hasta que se rodea de 8 electrones de valencia
estructura de lewis
presentación de un enlace , donde un par de electrones compartidos se indican como pares de puntos entre dos átomos
enlace covalente
es un enlace en el que dos electrones compartidos por dos átomos
enlace ionico
la fuerza electrostática que uno a los iones es un compuesto ionico
consiste en la 1° ley de la termodinámica, el cual el calor requerido por una cantidad de sustancia para cambiar de fase
H= E+Pv
cuando los reactivos se convierten en productos, el cambio entalpia es el mismo independiente de que se efectué la reacción
ley de los cambios químicos donde se pone e manifiesto la energía
produce
reaccion endotermica(+)
▲H>0
reacción exotermica(-)
▲H<0
aislado
no intercambia energía o materia con su entorno
abierto
puede intercambiar energía y materia con su entorno
cerrado
no intercambia materia, pero puede intercambiar energía con su entorno
capacidad para efectuar un trabajo
energía radiante
energía proveniente del sol y es la principal fuente de energía en la tierra
energía potencial
energía disponible en función a la posición de un objeto
energía química
energía que se almacena en las unidades estructurales de las sustancias
energía térmica
energía asociada al movimiento aleatorio de átomos y moléculas. se calcula por mediciones de temperatura
es la cantidad de soluto presente en una cantidad dada de disolvente o en una cantidad dada de disolución; dada en concentraciones molares
molaridad=moles de soluto/litos de disolucion
propiedades electrolíticas
todos los solutos que se disuelven en agua, se agrupan en
un no electrolito no conduce electricidad cuando se disuelve en agua
un electrolito es una sustancia que cuando se disuelve en agua conduce electricidad
una solución es una mezcla homogénea de dos o mas sustancias
disolvente
es la sustancia que esta en mayor cantidad
soluto
es una sustancia presente en menor cantidad
reacciones oxido-reducción
se caracteriza por un proceso de transferencia de protones
tipos
combustión
neutalizacion
reacciones acuosas acido-base. se forma de agua y sal con un cation(H+) y un anion distinto a (OH-) o (O2-)
ácido+ base→sal+ agua
propiedades
producen cambios de color en colorantes vegetales
las disoluciones acuosas conducen electricidad (base)
tienen sabor amargo
ácidos
las disoluciones acuosas conducen electricidad
reaccionan con algunos metales
ocasionan cambios de color
tienen sabor agrio
rendimiento real
cantidad de producto que se obtiene en una reacción, casi siempre es menor que el rendimiento teorico
rendimiento teórico
cantidad de producto que se obtendrá, si reacciona todo el reactivo limitante
el reactivo que se consume primero en una reacción limitante, ya que la reacción depende de este. los reactivos en exceso son los reactivos con mayor cantidad necesaria para reacción
presente en cantidades estequiometricas
[
es el estudio cuantitativo de reactivos y productos en una reaccion quimica
mediante
convierta los moles de producto en gramos de producto
utilice la relación molar de la ecuación para calcular el numero de moles del producto
convierta la cantidad conocida del reactivo en (gr) a moles
escriba la ecuación balanceada
reacciones de precipitación
tipo de reacción en disolución acuosa que se caracteriza por la formación de un producto insoluble o precipitado. un precipitado es un solido insoluble que se separa de la disolución (compuestos ionicos)
solubilidad
la solubilidad del soluto que se define como la cantidad máxima de soluto que se disolverá en una cantidad de disolvente
balanceo de ecuaciones
simplificar si es posible
se verifica la ecuación balanceada para asegurarse que hay el mismo numero de átomos tanto en reactivos y productos
se inicia probando diferentes coeficientes para igualar el numero de átomos en ambos lados
identificar reactivos y productos
se clasifica
cambios energéticos
endotermicas
absorben energia
exotermicas
liberan energía
procesos químicos
doble desplazamiento
AB+CD→AD+BC
desplazamiento
A+BC→AC+B
descomposición
AB→A+B
combinación
A+B→BC
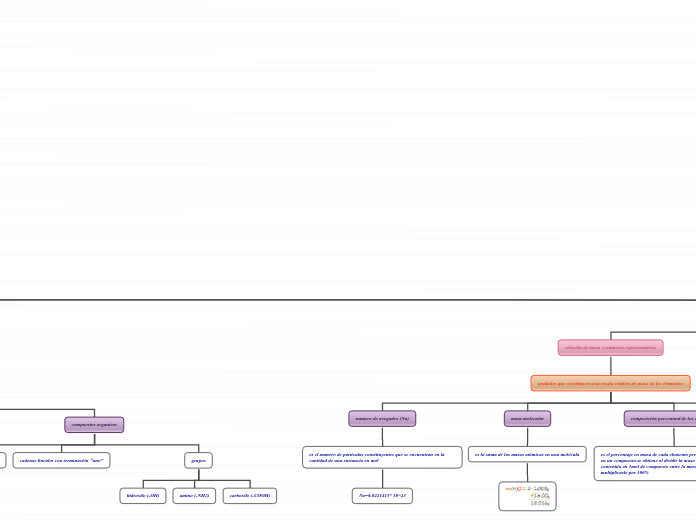
espectometro de masas
permite determinar la distribución de las moléculas de una sustancia en función de sus masas, en función de relación masa/carga
composición porcentual de los compuesto
es el porcentaje en masa de cada elemento presente de cada elemento en un compuesto.se obtiene al dividir la masa de cada elemento contenida en 1mol de compuesto entre la masa molar del compuesto y multiplicarlo por 100%
masa molecular
es la suma de las masas atómicas en una molécula
numero de avogadro (Na)
es el numero de partículas constituyentes que se encuentran en la cantidad de una sustancia en mol
Na=6.0221415* 10^23
compuestos organicos
grupos
carboxilo (-COOH)
amino (-NH2)
hidroxilo (-OH)
cadenas lineales con terminación "ano"
los hidrocarburos se componen de C y H
compuestos inorgánicos
ácidos y bases
bases
nomenclatura con palabras "anhidro"
liberan iones hidroxilo (OH-)
acidos
oxacidos son acidos que contiene H y O
aniones cuyo nombre "uro" y termina en "hidrico"
sustancia que libera iones (H+)
compuestos moleculares
prefijos griegos para la nomenclatura
se nombra 2° de la formula, a cuya raíz se le adiciona "uro" y después el 1° elemento
se excepciones componentes con H
compuestos ionicos
proveniente del nombre del elemento
asigna el sufijo "oso" al cation con menor carga y el sufijo "ico" al cation con mayor carga
formado por cationes (+) o aniones (-)
sufijo "uro"
expresa la composición de las moléculas y los compuestos ionicos por medio de símbolos
formulas empicas
se utiliza como antiseptico
modelos moleculares
observación de compuestos de manera directa
m. estructural
H-O-H
m. esferas
formulas moleculares
indica el numero exacto de átomos presentes en las sustancias
átomo que tiene carga neta positiva y negativa
iones monoatomicos
solo un átomo
iones poliatomicos
tienen mas de un átomo
es un agregado de por lo menos 2 átomos
enlaces quimicas
moléculas poliatomicas
NH3
H2O
molécula diatomica
Cl2
N2
no siempre es un compuesto
estuctura
electrón
masa del electrón=carga/masa
proton y núcleo
deben contener el mismo numero de cargas (+) y (-)
neutron
particulas electricamente neutral
ley de la conservación de la masa
LA MATERIA NO SE CREA NI SE CONSTRUYE, SOLO SE TRANSFORMA
proust
muestras diferentes de un mismo compuesto ya que contienen los mismos elementos y la misma proporcion de la masa
Democrito
reacción química implica combinación de átomos
elementos formados por partículas extremadamente por átomos
los átomos de un mismo átomo son idénticos
exactitud y precisión
precisión
cual estrechamente entre dos o mas mediciones
exactitud
cual cerca esta de la medición
cifras significativas
el margen de error de una medición es muy baja
notación científica
números expresados con forma NX10^n