によって piet henk 14年前.
1148
Scheikunde
Bij chemische reacties speelt de wet van behoud van massa een belangrijke rol, wat betekent dat de massa van de reactanten gelijk moet zijn aan de massa van de producten. Het opstellen van molecuulformules en het gebruik van Griekse telwoorden helpt bij het benoemen van stoffen.
開く
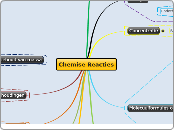
Chemise Reacties Reactievergelijkingen kloppend maken Links en Rechts van de pijl evenveel atomen van dezelfde soort! Je kan het beste de kant veranderen waar het het MINSTE effect heeft. DE INDEX MAG JE NOOIT VERANDEREN Kloppend maken betekent de juiste COËFFICIËNTEN verbeteren Overmaat Overmaat is het aantal gram van een stof dat je overhoudt (teveel hebt doordat je een VERKEERDE MASSAVERHOUDING hebt) Massa% Massa% = gram-ontstaan / gram-totaal x 100% Massaverhoudingen Bijvoorbeeld: Je hebt 3 g magnesium en 2 g zuurstof. er ontstaat 5 gram magnesiumoxide De massaverhouding is dus 3:2 Wet van behoud van massa De massa van de beginstoffen = De massa van de reactieproducten De reactiesnelheid is de hoeveelheid stof die in een bepaalde tijd verdwijnt of ontstaat. Je kunt de reacties sneller laten lopen door: Toevoegen van een katalysator Verhogen van de concentraties van de reagerende stoffen Vergroten van contactoppervlak Temperatuur verhogen Coëfficiënten Coëfficiënten geven aan hoeveel aantal moleculen er zijn. Bijvoorbeeld: 2 CH4 = CH4 + CH4 Molecuulformules opstellen Wat zijn de namen van de elementen in een verbinding? Waterstof = hydride Fluor = fluoride Broom = bromide Jood = jodide Chloor = chloride Zwavel = sulfide Zuurstof = oxide Wat zijn de Griekse telwoorden? Nona = negen Octa = acht Hexa = zes Penta = vijf Tetra = vier Tri = drie Di = twee Mono = één Wat zijn de cymbolen van de elementen? Concentratie Bij hogere concentraties verlopen reacties sneller. Energie Endotherme reactie Heeft altijd energie nodig om te blijven verlopen. Reactie waarbij energie NODIG is Exotherme reactie Heeft in het begin ook energie nodig. Daarna gaat dat vanzelf. Reactie waarbij energie VRIJKOMT