Se desplazan más los componentes de muestra que interactuán mejor con la fase móvil, es decir los más NO polares, los polares establecen interacciones con la fase móvil.
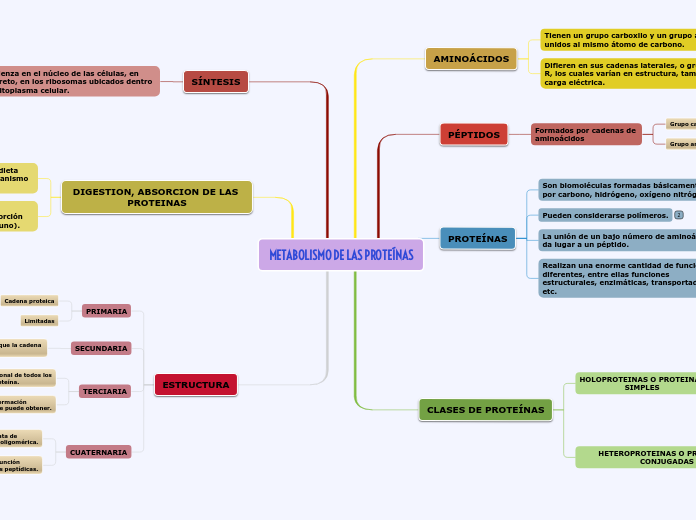
Técnicas de Cromatografía y Electroforesis.
Cromatografía de Afinidad
El segundo pico indicaría nuestra molécula ligada.
El primer pico indicaría todas las moléculas que no son de interés.
FASES
La matriz de gel con la resina de afinidad
Mezcla de las proteíanas a separar
Cromatografía de columna que purifica en base a su funcionalidad biológica
Receptor
Ligando
Enzima
Sustrato
Anticuerpo
Antígeno
Anclando covalentemente a un soporte uno de los complementarios de la molécula
Para separar nuestra molécula se le añade un ligando libre para hacer hacer competencia y eluir nuestra molécula de interés.
Cromatografía de Intercambio Iónico
Cromatograma
En un intercambio aniónico, la fase estacionaria está cargada positivamente. Las moléculas negativas se retienen por atracción, mientras que las positivas eluyen primero. Para liberar las negativas, se modifica el pH o se agrega sal. En la curva de elucion, el primer pico corresponde a las positivas y el segundo a las negativas.
Fundamento: separación basada en interacciones electrostáticas entre las moléculas y la fase estacionaria según sus cargas opuestas o iguales.
Etapas:
-Equilibrio: Acondicionamiento de la columna con un tampón para estabilizar la fase estacionaria.
-Aplicación: Introducción de la muestra, donde los analitos se retienen según su carga.
-Elución: Liberación de analitos por cambios en pH o fuerza iónica.
-Regeneración: Limpieza y restauración de la columna para su reutilización.
Fase móvil
-Carga: solución buffer inicial, diseñada para que las moléculas de interés se unan a la fase estacionaria.
-Elución: Cambios controlados en la fuerza iónica (incrementando la concentración de sal) o en el pH.
Fase estacionaria
Resina cargada, puede ser:
-Intercambiador catiónico: carga negativa que retiene iones positivos.
-Intercambiador aniónico: carga positiva que retiene iones negativos.
Intercambio aniónico y catiónico
Electroforesis
Fundamento: migración de moléculas a través de una matriz porosa, donde serán separadas según su tamaño o peso molecular por efecto de un campo eléctrico
Gel de poliacrilamida: mayormente separa proteínas
Gel de poliacrilamida
La intensidad de la tinción y
el grosor de las bandas indica
la abundancia de la proteínas.
Las proteínas más grandes
migran al otro extremo, las más
pequeñas quedan abajo.
Gel de agarosa: separa ácidos nucleicos y proteínas plasmáticas
Gel de agarosa
Ácidos nucleicos cargados
negativamente migran al ánodo
Las posiciones (altura) de las
bandas indican sus tamaños
Ejemplo de Cromatografía de Intercambio Catiónico
Extracción y purificación parcial de peroxidasa de
rabano (Raphanus sativus)
B. Actividad enzimática (parte inferior del gráfico)
Eje X (Número de fracción): Igual al gráfico anterior, muestra las fracciones recolectadas durante el proceso de elución.
Eje Y izquierdo (U/mg de proteína): Representa la actividad enzimática específica (Unidades por miligramo de proteína), medida como la capacidad de la enzima para catalizar la reacción.
Eje Y derecho (Unidades totales): Indica la actividad total de las enzimas presentes en cada fracción.
Pico principal (250 mM, pH 4.9): Este pico coincide con el de la absorbancia a 280 nm, indicando que la mayor actividad enzimática se encuentra en la fracción que eluye a esta concentración. Estas son las isoformas más básicas y activas de la peroxidasa.
Los picos reflejan cómo las proteínas y sus actividades se distribuyen entre las fracciones recolectadas.
El pico principal sugiere que la isoforma de mayor interés en este estudio (con mayor actividad específica y total) se encuentra en la fracción eludida a 250 mM de acetato de sodio.
A. Perfil cromatográfico (parte superior del gráfico)
Eje X (Número de fracción): Representa las fracciones recolectadas durante el proceso de elución. Cada fracción contiene una muestra del eluido de la columna.
Eje Y izquierdo (Absorbancia a 280 nm): Indica la cantidad de proteínas presentes en cada fracción, medida por su absorbancia en 280 nm, que detecta aminoácidos aromáticos.
Eje Y derecho (Concentración de acetato de sodio): Muestra el gradiente de concentración del eluyente (acetato de sodio) utilizado para liberar las proteínas unidas a la fase estacionaria.
Picos en el gráfico:
Cada pico corresponde a una población de proteínas que se eluyen de la columna a diferentes concentraciones de acetato de sodio.
Pico principal (250 mM, pH 4.9): Se observa el pico más grande, que indica una alta concentración de proteínas que se eluyeron en esta etapa. Estas proteínas incluyen las isoformas más básicas de la peroxidasa.
Picos más pequeños: Representan proteínas eluidas a concentraciones menores de acetato de sodio (formas ácidas o neutras).
Posiciones relativas de las isoformas (A, B, C, D, E): Basado en estudios previos (Shannon et al.), estas letras indican diferentes isoformas de la peroxidasa que se separan en la columna debido a diferencias en su carga.
Fase estacionaria: Es la matriz de carboximetil-celulosa (CM-52) utilizada como soporte para el intercambio catiónico.
Fase móvil: Es el eluyente utilizado en la cromatografía de intercambio catiónico con carboximetil-celulosa (CM-52). Aquí se usaron gradientes de acetato de sodio en concentraciones crecientes (5 mM, 50 mM, 100 mM y 250 mM) a pH 4.4 y 4.9.
FUENTES
Osorio Zapata, G. V., & Picado Peñalba, E. E. (2005). Estudio preliminar para el desarrollo del método" determinación de aniones en aguas naturales por cromatografía de intercambio iónico (Doctoral dissertation).
Mayolo-Deloisa, K., Martínez, L., & Rito-Palomares, M. (n.d.). Técnicas cromatográficas y su aplicación a estudios de cambios conformacionales, estabilidad y replegamiento de proteínas. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1665-27382012000300006
https://lh6.googleusercontent.com/proxy/KREy8s5ywicDGyxYBdnGmyvk3lYOBQEaB3ok1p-MJI-4KLbnrcLi7odOAl2rTZZtge6VVZcZ-eqvkNpI2F_X7pyA85-PIyt8Bva61Hay
Cromatografía de Exclusión Molecular
Filtración en Gel
CROMATOGRAMA
Añada su texto
Segundo pico - Moléculas azules
Segundo pico - Moléculas verdes
Primer pico - Moléculas rojas
FASES
Fase Móvil
Cualquier solución que no desnaturalice la molécula.
Buffer pH=7
Fase Estacionaria
Gel con partículas esféricas que contienen los poros.
Cada gel tiene un intervalo de fraccionamiento que nos permite considerar el tamaño de las moléculas a separar.
FUNDAMENTO
Separa moléculas en base a su tamaño mediante un gel que contiene poros de tamaños específicos.
Eluyendo primero las partículas de mayor tamaño y siendo las más pequeñas las últimas en eluir.
Cromatografía en capa fina (TLC)
Móvil: Solventes de menor polaridad, eluyentes.
Estacionaria: Placa de vidrio con gel de sílice sílice (SiO2) y
a alúmina (Al2O3), amabas polares.
Cromatografía en papel
fases
Móvil: Solventes
ejemplos
Estacionaria: Celulosa con agua dentro de un soporte (el papel).
fundamento
Técnica basada en la diferencia de polaridad de los componentes de la mezcla.