によって Benítez Regina 3年前.
781
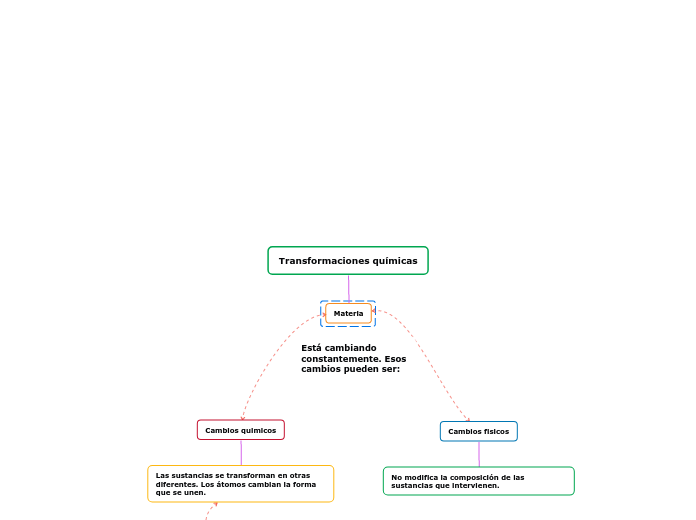
Transformaciones químicas
Existen diversos tipos de transformaciones que afectan a la materia, las cuales pueden ser físicas o químicas. Los cambios físicos no alteran la composición de las sustancias, mientras que los cambios químicos implican la formación de nuevas sustancias mediante la modificación de los enlaces entre átomos.