by Katia Ledra 1 year ago
145
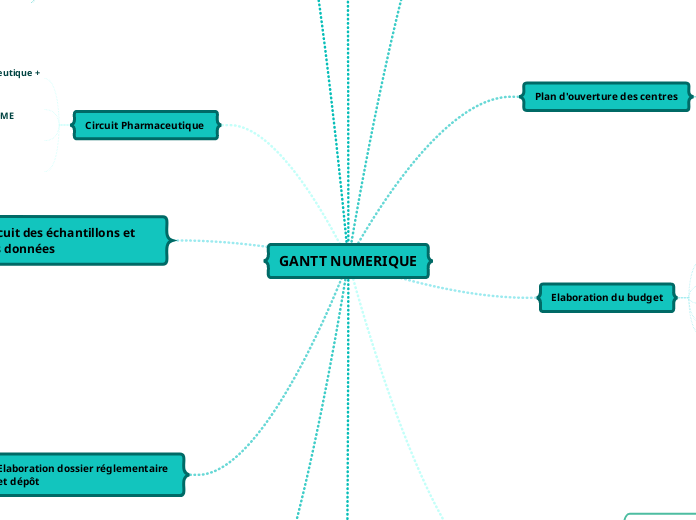
GANTT NUMERIQUE
La mise en place d'un projet de recherche implique plusieurs étapes clés, toutes cruciales pour assurer le bon déroulement et la validité scientifique de l'étude. La phase initiale comprend la création et la structuration du projet, suivies de l'