LEY DE LOS GASES TRIPLES
LEYES MENCIONADAS SE OBTIENE LA LEY COMBINADADE LOS GASES IDEALES O LEY DE LOS CAMBIOS TRIPLES
P1.V1/T1 = P2.V2=T2
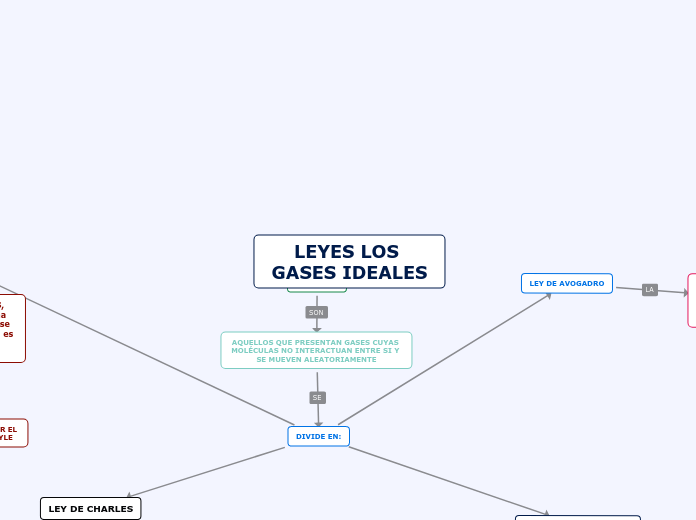
LEYES LOS GASES IDEALES
GAS IDEAL
AQUELLOS QUE PRESENTAN GASES CUYAS MOLÉCULAS NO INTERACTUAN ENTRE SI Y SE MUEVEN ALEATORIAMENTE
DIVIDE EN:
LEY DE AVOGADRO
LEY DE AVOGADRO ESTABLESE QUE EL VOLUMEN DE UNGAS MANTENIDO A TEMPERATURA Y PRECION CONSTANTE, ES DIRECTAMENTE PROPORCIONAL AL NUMERO DE MOLES DE GAS PRESENTE
P1/n1 = P2/N2
V1/n1 = V2/n2
LEY DE CHARLES
LA LEY DE CHARLE Y GAY LUSSAC SE RESUMEN EN: el volumen de una determinada cantidad de gas que se mantiene a precion constante, es directamente proporcional a su temperatura absoluta
PRODUCE VOLUMEN CONSTANTE SE DENOMINA PROCESOS ISOCORICOS
V1/T1 = V2/T2
PRECION DE UNA DETERMINADA CANTIDAD DE GAS SE MANTIENE A VOLUMEN CONSTANTE, ES DIERECTAMENTE PROPORCIONAL A SU TEMPERATURA ABSOLUTA
VOLUMEN CONSTANTE SE DENOMINA PROCESO ISOCORICO
P1/T1 = P2/T2
LEY DE BOLEY
RESUME ESTAS OBSERVACIONES, ESTABLES QUE: el volumen de una determinada cantidad de gas que se mantiene atemperatura constante, es inversamente proporcional a la precion que ejerce
P1 . V1 = P2 . V2
DENOMINA QUE SON ISOTERMICOS POR EL PROCESO QUE CUMPLE LA LEY DE BOYLE