PROPIEDADES Y ESTRUCTURA DE LA MATERIA.
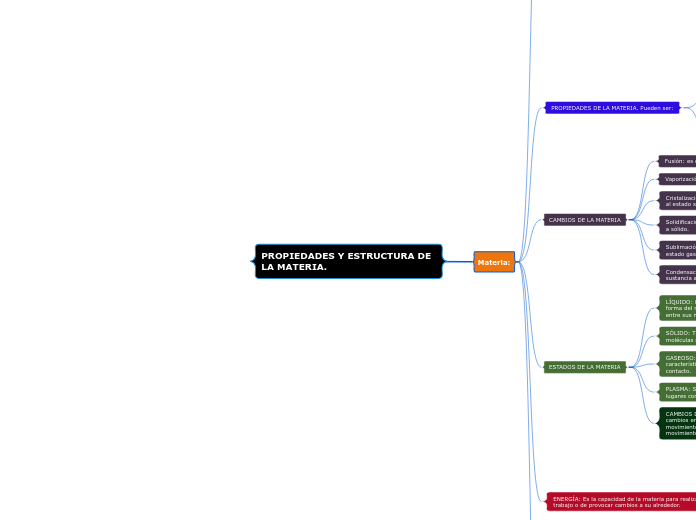
Materia:
ÁTOMO: Es la unidad más básica de la materia sin que pierda sus propiedades químicas.
Fue nombrado así por Demócrito de Abdera (460-370 a.C.). Propuso que el universo estaba formado por átomos y espacio vacío.
ESTRUCTURA DEL ÁTOMO: Todos los átomos están formados por 3 partículas.
NÚMERO, MASA Y CARGA.
NÚMERO DE MASA (A): Suma de protones y neutrones.
NÚMERO ATÓMICO (Z): Número de protones en un átomo.
ELECTRONES (-): Partículas negativas que orbitan alrededor del núcleo.
NEUTRONES (n): Partículas sin carga, que de igual manera se encuentran en el núcleo, que es donde se encuentra la mayor parte de la masa del átomo.
PROTONES (+): Partículas positivas que se encuentran en el núcleo. Le dan su identidad al átomo como elemento.
MODELOS ATÓMICOS
*APORTACVIONES ADICIONALES*
Eugen Goldstein (1850-1930)
Robert A. Millikan (1868-1953)
James Chadwick (1891-1974)
Arnold Sommerfeld (1868-1951): Propuso que el átomo tiene órbitas elípticas además de circulares. Sugirió la existencia de subniveles de energía a partid de la segunda orbita.
Niels Bohr (1885-1962): Se basó en las leyes del movimiento planetario de Johannes Kepler. Propone un modelo que explica el espectro de líneas del hidrógeno.
Ernest Rutherford (1871-1937): Descubridor del núcleo positivo y alrededor giran los electrones. Su descubrimiento surge a partir de un experimento en el que bombardeó una delgada lámina de oro con partículas positivas.
Joseph John Thomson (1856-1940): Descrubridor del electrón en 1897 durante un experimento con rayos catódicos, propone el modelo atómico conocido como BUDÍN DE PASAS.
John Dalton (1766-1844): Propone los siguientes postulados: los átomos no pueden dividirse, destruirse ni modificarse, todos los átomos de un elemento son iguales entre sí, entre otros.
ENERGÍA: Es la capacidad de la materia para realizar un trabajo o de provocar cambios a su alrededor.
NUCLEAR (fisión/fusión del núcleo).
MECÁNICA (potencial y cinética).
ELÉCTRICA.
QUÍMICA (enlaces químicos).
CALORÍFICA o térmica.
LUMINOSA o radiante.
ESTADOS DE LA MATERIA
CAMBIOS DE LA MATERIA: Se produce principalmente por cambios en la temperatura; si esta aumenta hay mayor movimiento entre sus partículas y si disminuye hay menos movimiento entre ellas.
PLASMA: Solo se encuentra fuera de la Tierra y abunda en lugares como el Sol y las estrellas.
GASEOSO: No tienen forma ni volumen, tienen la característica que se mezclan entre sí cuando se ponen en contacto.
SÓLIDO: Tiene forma y volumen, esto se debe a que sus moléculas se atraen fuertemente
LÍQUIDO: No tienen una forma específica, sino que toman la forma del recipiente que los contiene. La fuerza de cohesión entre sus moléculas es poca.
CAMBIOS DE LA MATERIA
Condensación: es el cambio de estado que se produce en una sustancia al pasar del estado gaseoso al estado líquido.
Sublimación: es el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido.
Solidificación: es el cambio de estado de la materia de líquido a sólido.
Cristalización: es el cambio de la materia del estado gaseoso al estado sólido sin pasar por el estado líquido.
Vaporización: es cuando un líquido se transforma en gas.
Fusión: es cuando un sólido se transforma en líquido.
PROPIEDADES DE LA MATERIA. Pueden ser:
QUÍMICAS: Se relaciona con la capacidad de una sustancia para transformarse en otra.
FÍSICAS: Su observación o determinación no modifica la composición interna de la materia.
INTENSIVAS: También conocidas como intensivas o específicas; son independientes de la cantidad de materia.
EXTENSIVAS: También conocidas como generales, depende de la cantidad de materia.
Se define ésta como todo lo que ocupa un lugar en el espacio y posee masa cuantificable. Se divide en dos
Mezclas: Es la combinación de dos o más sustancias, donde la identidad básica de cada una no se altera, o sea, no pierden sus propiedades y características.
MÉTODOS DE SEPARACIÓN DE MEZCLAS: De forma natural es muy difícil que las sustancias puras por lo que se requiere un método para realizarlo. Existen diferentes métodos y son:
EVAPORACIÓN: Es un método físico que permite separar un sólido de un líquido en una mezcla homogénea. Se basa en que el punto de fusión del sólido es mayor al punto de ebullición del líquido.
CRISTALIZACCIÓN: Este método se utiliza para separar una mezcla de un sólido en un líquido. La mezcla se calienta para evaporar parte del disolvente. Posteriormente se deja enfriar la mezcla y el soluto se precipita formando cristales.
DESTILACIÓN: Consiste en separar dos o más líquidos miscibles con diferentes puntos de ebullición, primero por medio de la evaporación posteriormente por la condensación de las sustancias.
CROMATOGRAFÍA: Este método depende de la distribución de los componentes de la mezcla entre dos fases inmiscibles. Una fase móvil, llamada activa, que transporta las sustancias que se separaron y que progresa en relación con otra, denominada fase estacionaria.
SEDIMENTACIÓN: Es un método basado en la diferencia de densidades de los componentes de la mezcla, que permite separar mezclas heterogéneas de un sólido en un líquido mediante reposo o precipitación.
DECANTACIÓN: Se utiliza para separar dos líquidos con diferentes densidades o una mezcla constituida por un sólido insoluble en un líquido.
FILTRACIÓN: Se trata de una operación que permite separar mezclas heterogéneas de un sólido insoluble en un líquido. Se hace pasar la mezcla a través de un papel filtro, el sólido se quedará en la superficie del papel y el otro componente pasará.
CENTRIFUGACIÓN: Se trata de una operación que consiste en la separación de materiales de diferentes densidades que componen una mezcla. Para eso se coloca la mezcla dentro de un aparato llamado centrífuga que tiene un movimiento de rotación constante y rápido, lo cual hace que las partículas de mayor densidad vayan al fondo y las más livianas queden en la parte superior.
IMANTACIÓN: Consiste en separar con un imán los componentes de una mezcla de un material magnético y otro que no lo es.
HETEROGÉNEA: Tienen una composición no uniforme, sus componentes pueden distinguirse a simple vista. EJEMPLOS: el agua con aceite, las ensaladas, el aire y la gasolina dentro de un motor.
HOMOGÉNEA: También llamadas disoluciones. Tienen una apariencia totalmente uniforme y sus componentes no pueden distinguirse a simple vista. EJEMPLOS: el café, el agua y el alcohol, entre otros.
SUSTANCIAS PURAS: Son aquellas en las que su composición no varía. No pueden descomponerse en otras sustancias.
COMPUESTOS: Son sustancias puras que sí se pueden descomponer en otras más simples, por medio de métodos químicos. En su fórmula aparecen los símbolos de dos o más elementos. Por ejemplo: el amoniaco (NH3).
ELEMENTOS: Están formadas por un único átomo. En su fórmula química solo aparece el símbolo de un elemento. Por ejemplo: el dioxígeno (O2).