La reacción química también se puede definir desde dos enfoques, el macroscópico que la define como «un proceso en el cual una o varias sustancias se forman a partir de otra u otras» y el nanoscópico cuya definición sería: «redistribución de átomos e iones, formándose otras estructuras (moléculas o redes)
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
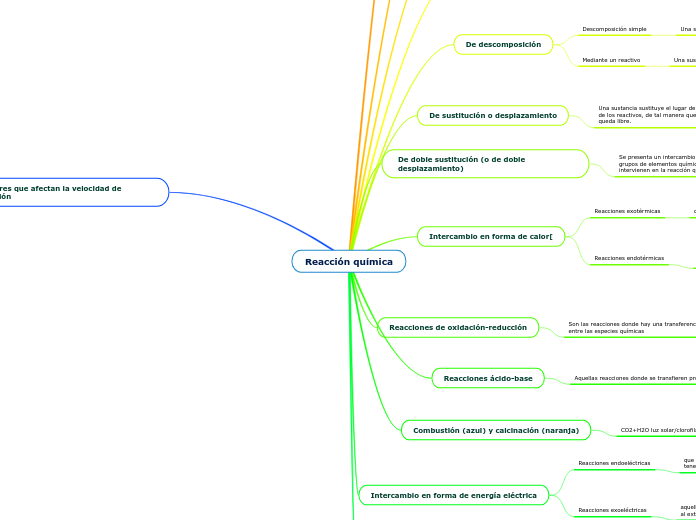
Reacción química
Factores que afectan la velocidad de reacción
Orden: El orden de la reacción controla cómo afecta la concentración (o presión) a la velocidad de reacción.
Temperatura: Generalmente, al llevar a cabo una reacción a una temperatura más alta provee más energía al sistema, por lo que se incrementa la velocidad de reacción al ocasionar que haya más colisiones entre partículas, como lo explica la teoría de colisiones. Sin embargo, la principal razón porque un aumento de temperatura aumenta la velocidad de reacción es que hay un mayor número de partículas en colisión que tienen la energía de activación necesaria para que suceda la reacción, resultando en más colisiones exitosas. La influencia de la temperatura está descrita por la ecuación de Arrhenius. Como una regla de cajón, las velocidades de reacción para muchas reacciones se duplican por cada aumento de 10 °C en la temperatura, aunque el efecto de la temperatura puede ser mucho mayor o mucho menor que esto. Por ejemplo, el carbón arde en un lugar en presencia de oxígeno, pero no lo hace cuando es almacenado a temperatura ambiente. La reacción es espontánea a temperaturas altas y bajas, pero a temperatura ambiente la velocidad de reacción es tan baja que es despreciable. El aumento de temperatura, que puede ser creado por una cerilla, permite que la reacción inicie y se caliente a sí misma, debido a que es exotérmica. Esto es válido para muchos otros combustibles, como el metano, butano, hidrógeno, etc.
La velocidad de reacción puede ser independiente de la temperatura (no Arrhenius) o disminuir con el aumento de la temperatura (anti Arrhenius). Las reacciones sin una barrera de activación (por ejemplo, algunas reacciones de radicales) tienden a tener una dependencia de la temperatura de tipo anti Arrhenius: la constante de velocidad disminuye al aumentar la temperatura.
Isótopos: El efecto isotópico cinético consiste en una velocidad de reacción diferente para la misma molécula si tiene isótopos diferentes, generalmente isótopos de hidrógeno, debido a la diferencia de masa entre el hidrógeno y el deuterio, ya que el átomo más pesado conlleva generalmente a menor frecuencia vibracional de estos, por lo que es requerida mayor cantidad de energía para hacer frente a la mayor energía de activación para romper el enlace.
Mezclado: El mezclado puede tener un efecto fuerte en la velocidad de reacción para las reacciones en fase homogénea y heterogénea.
Superficie de contacto: En las reacciones en superficies, que se dan por ejemplo durante catálisis heterogénea, la velocidad de reacción aumenta cuando el área de la superficie de contacto aumenta. Esto es debido al hecho de que más partículas del sólido están expuestas y pueden ser alcanzadas por moléculas reactantes.
Catalizador: La presencia de un catalizador incrementa la velocidad de reacción (tanto de las reacciones directa e inversa) al proveer de una trayectoria alternativa con una menor energía de activación. Por ejemplo, el platino cataliza la combustión del hidrógeno con el oxígeno a temperatura ambiente. La catálisis es homogénea si el catalizador está en una fase similar a los reactivos y heterogénea si está en una fase diferente.
Radiación electromagnética e intensidad de luz: La radiación electromagnética es una forma de energía. Como tal, puede aumentar la velocidad o incluso hacer que la reacción sea espontánea, al proveer de más energía a las partículas de los reactantes. Esta energía es almacenada, en una forma u otra, en las partículas reactantes (puede romper enlaces, promover moléculas a estados excitados electrónicos o vibracionales, etc.), creando especies intermediarias que reaccionan fácilmente. Al aumentar la intensidad de la luz, las partículas absorben más energía, por lo que la velocidad de reacción aumenta. Por ejemplo, cuando el metano reacciona con cloro gaseoso en la oscuridad, la velocidad de reacción es muy lenta. Puede ser acelerada cuando la mezcla es irradiada bajo luz difusa. En luz solar brillante, la reacción es explosiva.
Solvente: Muchas reacciones tienen lugar en solución, y las propiedades del solvente afectan la velocidad de reacción. La fuerza iónica también tiene efecto en la velocidad de reacción.
Presión: La velocidad de las reacciones gaseosas se incrementa muy significativamente con la presión, que es, en efecto, equivalente a incrementar la concentración del gas. Para las reacciones en fase condensada, la dependencia en la presión es débil, y solo se hace importante cuando la presión es muy alta.
Concentración: La velocidad de reacción aumenta con la concentración, como está descrito por la ley de velocidad y explicada por la teoría de colisiones. Al incrementarse la concentración de los reactantes, la frecuencia de colisión también se incrementa.
Naturaleza de la reacción: Algunas reacciones son, por su propia naturaleza, más rápidas que otras. El número de especies reaccionantes, su estado físico las partículas que forman sólidos se mueven más lentamente que las de gases o de las que están en solución, la complejidad de la reacción, y otros factores pueden influir enormemente en la velocidad de una reacción. Por ejemplo, la reacción de los metales alcalinos con sustancias como el oxígeno o el agua es inmediata al ser los primeros mencionados bastante reactivos.
Intercambio en forma de luz[
Reacciones exoluminosas
reacciones que al llevarse a cabo manifiestan una emisión luminosa
Combustión del magnesio:
2Mg+O2 + ΔH → 2MgO + Luz
Reacciones endoluminosas
que requieren el aporte de energía luminosa o luz al sistema para llevarse a cabo.
Fotosíntesis
a fotosíntesis o función clorofílica es la conversión de materia inorgánica a materia orgánica gracias a la energía que aporta la luz. En este proceso la energía lumínica se transforma en energía química estable, siendo el NADPH (nicotín adenín dinucleótido fosfato) y el ATP (adenosín trifosfato) las primeras moléculas en la que queda almacenada esta energía química.
Intercambio en forma de energía eléctrica
Reacciones exoeléctricas
aquellas reacciones químicas en las que el sistema transfiere al exterior energía eléctrica
Celda galvánica (pila o batería eléctrica)
La celda galvánica o celda voltaica, denominada en honor de Luigi Galvani y Alessandro Volta respectivamente, es una celda electroquímica que obtiene la energía eléctrica a partir de reacciones redox espontáneas que tienen lugar dentro de la misma. Por lo general, consta de dos metales diferentes conectados por un puente salino, o semiceldas individuales separadas por una membrana porosa. Volta fue el inventor de la pila voltaica, la primera pila eléctrica.
Reacciones endoeléctricas
que requieren el aporte de energía eléctrica para que puedan tener lugar
Electrólisis del agua
es un proceso por el cual se separan las moléculas de oxígeno y las moléculas de hidrógeno del agua mediante una corriente eléctrica
Combustión (azul) y calcinación (naranja)
CO2+H2O luz solar/clorofila= C6H12O6+O2
Electrolisis del agua
Reacción de pila comercial
Reacciones ácido-base
Aquellas reacciones donde se transfieren protones
HCl(aq) + NaOH(aq) → H2O(l) + NaCl(aq)
Reacciones de oxidación-reducción
Son las reacciones donde hay una transferencia de electrones entre las especies químicas
Mn2(aq) + BiO3- (s) → Bi3(aq) + MnO4-(aq)
Intercambio en forma de calor[
Reacciones endotérmicas
reacciones en las que se absorbe o se requiere calor para llevarse a cabo.
Calcinación
es el proceso de calentar una sustancia a temperatura elevada, (temperatura de descomposición), para provocar la descomposición térmica o un cambio de estado en su constitución física o química. El proceso, que suele llevarse a cabo en largos hornos cilíndricos, tiene a menudo el efecto de volver frágiles las sustancias.
Reacciones exotérmicas
que desprenden calor del sistema de reacción
Combustión
en sentido amplio, puede entenderse como toda reacción química, relativamente rápida, de carácter notablemente exotérmico, que se desarrolla en fase gaseosa o heterogénea (líquido-gas, sólido-gas) con o sin manifestación de llamas o de radiaciones visibles.
De doble sustitución (o de doble desplazamiento)
Se presenta un intercambio entre los elementos químicos o grupos de elementos químicos de las sustancias que intervienen en la reacción química.
AB + CD → AC + BD
Pb (NO3)2 (ac) + 2 KI (ac) → Pbl2 (s) + 2 KNO3 (ac)
De sustitución o desplazamiento
Una sustancia sustituye el lugar de alguno de los componentes de los reactivos, de tal manera que el componente sustituido queda libre.
AB +C → AC + B
(donde el compuesto AB reacciona con el reactivo C para formar el compuesto AC y liberar B)
2 NaI + Br2 → 2 NaBr + I2
De descomposición
Mediante un reactivo
Una sustancia requiere un reactivo, para su descomposición.
AB + C → AC + BC
(el compuesto AB reacciona con el reactivo C, para originar los compuestos AC y BC)
2 ZnS (S) + 3 O2 (g) → 2 ZnO (S) + 2 SO2 (g)
Descomposición simple
Una sustancia compuesta se desdobla en sus componentes
A → B + C
(inversa de la síntesis, y A es un compuesto que se descompone en los reactivos que lo componen, B y C).
CO2 (g) → CO2 (g) C(s) + O2 (g)
De síntesis o de combinación
Donde los reactivos se combinan entre sí para originar un producto diferente
representación A + B → C
(siendo A y B reactivos cualesquiera y C el producto formado)
Ejemplo 2 Na (s) + Cl2 (g) → 2 NaCl (s)
Reacciones de la química inorgánica
Desde un punto de vista de la química inorgánica se pueden postular dos grandes modelos para las reacciones químicas de los compuestos inorgánicos: reacciones ácido-base o de neutralización (sin cambios en los estados de oxidación) y reacciones redox (con cambios en los estados de oxidación)
Fenómeno químico
Se llama fenómeno químico a los sucesos observables y posibles de ser medidos en los cuales las sustancias intervinientes cambian su composición química al combinarse entre sí Las reacciones químicas implican una interacción que se produce a nivel de los electrones de valencia de las sustancias intervinientes. Dicha interacción es el enlace químico.
En estos fenómenos, no se conserva la sustancia original, se transforma su estructura química, manifiesta energía, no se observa a simple vista y son irreversibles, en su mayoría.
La sustancia sufre modificaciones irreversibles. Por ejemplo, al quemarse, un papel no puede volver a su estado original. Las cenizas resultantes formaron parte del papel original, y sufrieron una alteración química.
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más especie químicas o sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.