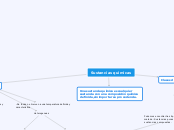
m * (6,022*10²³)
m ·/. (6,022*10²³)
m * g
g·/.g
MOLECULAS
MOL
EQUIVALE A LA
MASA DE LOS
ÁTOMOS
1 MOL = NA
NA = número de Avogadro
NÚMERO DE AVOGADRO
El número de avogadro es igual a 6,022 * 10²³ y se usa para contar cosas como moléculas o átomos.
UNIDAD DEL SI
( cantidad de la masa )
PARA
La obtención de nuevos productos y procesos, e introducirlos en el mercado.
T7 CÁLCULOS
QUÍMICOS
TIPOS DE REACCIONES QUÍMICAS
PARTÍCULAS INTERCAMBIADAS
OXIDACIÓN REDUCCIÓN
PRECIPITACIÓN
PRECIPITACIÓN : formación de un sólido que “precipita”, por eso, a este sólido también se le llama precipitado.
AgNO3 (aq) + NaCl (aq) = NANO3 (aq) + AgCl (s)↓
NEUTRALIZACIÓN O ÁCIDO BASE
transferencia de hidrones de un ácido a una base.
ácido + base = sal + agua
MECANISMO DE INTERCAMBIO
DOBLE DESPLAZAMIENTO / AB + CD = CB + AD
DESPLAZAMIENTO / A + BC = AB + C
DESCOMPOSICIÓN / AB = A+B
SÍNTESIS / A+B =AB
LEY DE LAVOISIER
Lavoisier midió en un recipiente cerrado las masas del sólido y aire antes y después de la combustión llegó a la conclusión de que la masa que ganaba el metal era igual a la que perdía el aire.
MASA REACTIVO + MASA REACTIVO = MASA PRODUCTO + MASA PRODUCTO
SE CUMPLE EN CUALQUIER REACCIÓN QUÍMICA
LEY DE CONSERVACIÓN DE LA MASA
AJUSTE DE REACCIONES QUÍMICAS
Se iguala la cantidad de producto y reactivos atendiendo al hecho de que la materia no se crea ni se destruye solo se transforma.
EJEMPLO
H2 + O2 = H2O / 2H2 + O2 = 2H2O
= IGUALAR
REACTIVO
PRODUCTO
RESIDUO / SUBPRODUCTO
SUBPRODUCTO
SE PUEDE UTILIZAR
como materia prima
RESIDUO
SE DESECHA
NO TIENE UTILIDAD
I+D+i
SIRVE
Mejorar los conocimientos
Científicos
Técnicos
Innovación
Desarrollo
Investigación
SINTÉTICO / NATURAL
NATURAL
Obtenidas a partir de materiales naturales
SINTÉTICO
Obtenidas a partir de procesos químicos
MASA
MOLECULAR
Masa molar es la masa en gramos de 1 mol de la sustancia.
ÁCIDO SULFÚRICO
H2SO4 - A (H=1) / A (S=32) / A (O=16)
M= (1*2) + (32) + (16*4) = 98g
/ g = gramos /
MOLAR
Suma de los átomos que componen una sustancia.
ÁCIDO SULFÚRICO
H2SO4 - A (H=1) / A (S=32) / A (O=16)
M= (1*2) + (32) + (16*4) = 98u
/ u = unidades / / A = número máxico /
CONVERSIÓN
ENTRE
MOLÉCULAS
MOLES
GRAMOS
VELOCIDAD DE LA REACCIÓN
CATALIZADOR
sustancias que no afectan al compuesto pero modifican el mecanismo de reacción cambiando la energía de activación y aumentando la velocidad de reacción.
DIVISIÓN DE LOS REACTIVOS
CONCENTRACIÓN DE LOS REACTIVOS
TEMPERATURA DE LA REACCIÓN
PROBLEMAS AMBIENTALES
AGUJERO DE OZONO
Por
Subtopic
clorofluorocarbonos (CFC)
aerosoles
agujero de ozono
zona donde ha disminuido la concentración de ozono
ozono (O3)
Forma capa de ozono en la estratosfera
( ozonosfera )
filtro contra la radiación solar.
EFECTO INVERNADERO
Impiden que los rayos solares salgan de la tierra
ACUMULACIÓN
GASES
óxidos de nitrógeno (NOx)
Combustibles fósiles (CO2)
metano (CH4)
vapor de agua
Aumento de la temperatura media del planeta
LLUVIA ÁCIDA
Reaccionan con el agua de las nubes
PROVOCANDO
Ácidos
destrozan
Construcciones
Fauna
Flora
dióxido de azufre (SO2) / los óxidos de nitrógeno (NOx),
PROCEDENTES
transporte
industria
DESAROLLO SOSTENIBLE
NO COMPROMETER LAS GENERACIONES FUTURAS
SATISFACER GENERACIONES PRESENTES