av Илья Дисс 6 år siden
430
Химия
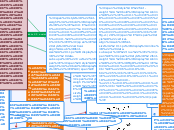
aA+bB=cC+dD
V=k*[A]a+[B]b
Газ+тв.вещ.во
Fe + 2HCl = FeCl2 + H2
↓ ↓ ↓ ↓
метал. связь ков. пол. ионная ков.непол
Чтобы оценить энергозатраты на процесс без учета потерь тепла плавильным агрегатом необходимо верно рассчитать энтальпию(∆Н)
Атом представляет собой сложную микросистему находящихся в движении и взаимодействующих друг с другом элементарных частиц.
С помощью расчета энергии Гиббса для одной реакции при различных температурах определяют :
чтобы узнать температуру начала самопроизвольной реакции
уточняют нижнюю температурную границу для рассматриваемого восстановительного либо окислительного процесса
температуру начала самопроизвольного протекания реакции
Большое выделение энергии
Mg+1/2O2=MgO(оксид)
∆Н=-602,5
↓
∆Н=∑Нпр.-∑Нисх
(из закона Гесса)
Образуется молодес. вещ
H2O
Выпадает:
Осадок↓
или выделяется газ↑
Если Кр<1
←(влево)
Если Кр>1
→(вправо)
Константа равновесия К
aA+bB+cC+dD
[прод]↑←
[исх]↑→
Концентрация С
P↓→большего объема V↑
Р↑→меньшего объема V↓
Давление в газах P
Факторы влияния
Химическое равновесие:
V→=V←
∆Н<0→экзотермическая Т↓
Температура Т
∆Н>0→эндотермическая Т↑
Природа
Катализатор kat
Гетерогенные реакции:
газ + жидкость
газ + твердое вещество
жидкость + твердое вещество.
Гомогенные
реакции:
A+B+K→AB+K
2KOH+H2SO4→K2SO4+2H2O
гидроксид кислота соль оксид
↓ ↓ ↓ ↓
ОН кислотный средняя О
остаток
Закон действующих масс
Концентрация
Факторы влияющие на V:
Температура
Уравнение Аррениуса
Правило Вант-Гоффа
Химическая кинетика(изучает V химических реакций)
Химические реакции
Химическое неравновесие
V→≠V←
Гетерогенные
Гомогенные
Необратимые
Обратимые
→
←

