av Ernesto Rafael de Jes�s Torrez Alvarado 3 år siden
464
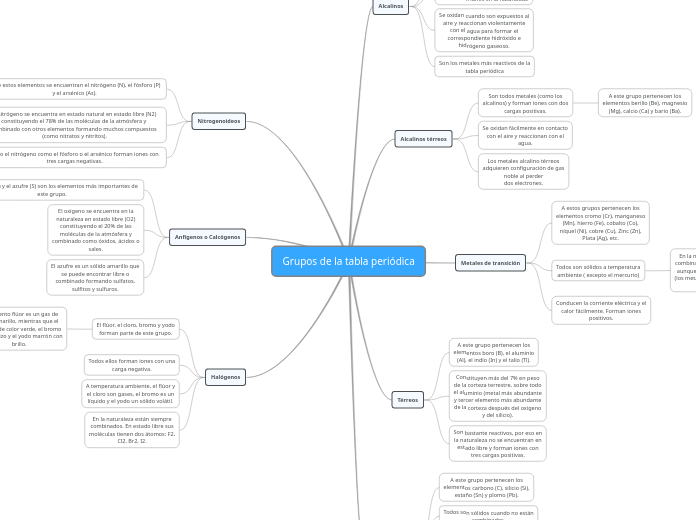
Grupos de la tabla periódica
av Ernesto Rafael de Jes�s Torrez Alvarado 3 år siden
464

Mer som dette