av Valeria Pérez 3 år siden
135
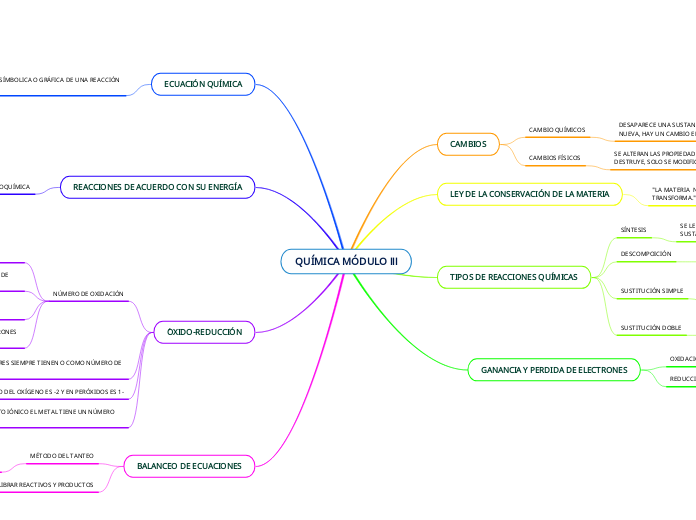
QUÍMICA MÓDULO lll
Las ecuaciones químicas representan de manera simbólica o gráfica las reacciones químicas, mostrando los cambios que sufren la materia y sus elementos. En estas ecuaciones, los reactivos se colocan a la izquierda y los productos a la derecha, indicando el estado de la materia mediante subíndices.